
Wetenschap
Stervormige nanodeeltjes die hun medicijnlading pas vrijgeven nadat ze cellen zijn binnengekomen
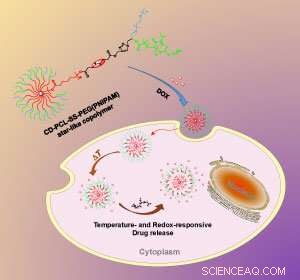
De verandering in temperatuur en chemische omgeving in de cel zorgt ervoor dat het nanodeeltje zijn nuttige lading vrijgeeft. Krediet:The Royal Society of Chemistry
A*STAR-onderzoekers hebben deeltjes voor medicijnafgifte op nanoschaal ontwikkeld die hun omgeving kunnen waarnemen, en hun lading pas vrijgeven nadat ze een cel zijn binnengegaan, een ontdekking die veel bestaande medicijnen effectiever zou kunnen maken.
De nieuwe nanodeeltjes, ontwikkeld door Zibiao Li van het A*STAR Institute of Materials Research and Engineering en zijn medewerkers, zijn een belangrijke upgrade van eerdere generaties op polymeren gebaseerde nanodeeltjes voor medicijnafgifte. Vroege voorbeelden bestonden meestal uit eenvoudige polymeerketens met een polaire, hydrofiele kop en een niet-polaire, hydrofobe staart. In water, deze ketens aggregeren van nature in bollen, met hun hydrofobe staarten allemaal naar binnen gericht om een niet-polaire kern te vormen. De kern vormde een goede plek voor medicijnmoleculen om zich te nestelen. In de bloedbaan, echter, deze aggregaten hebben de neiging om uit elkaar te worden gescheurd.
Li en zijn collega's gebruikten de nieuwste polymeersynthesetechnieken om nanodeeltjes met één molecuul te maken. In plaats van een zelf-geassembleerd aggregaat van afzonderlijke polymeren, het team synthetiseerde een robuustere structuur waarin de polymeerketens sterk covalent gebonden waren aan een centrale kern. De synthese begon met beta-cyclodextrine, een cirkelvormig suikermolecuul met 21 hydroxylgroepen op het oppervlak. De hydroxylgroepen vormden de chemische ankers waaruit het team de meervoudige lange, Y-vormig, multifunctionele polymeer armen.
"De grootste uitdaging bij het maken van het [nanodeeltje] was om verschillende synthetische methoden te integreren in één macromoleculair ontwerp, " zegt Li. Aan een van de uiteinden van elke Y-vormige tak, het team bevestigde een temperatuurgevoelig polymeer genaamd PNIPAM. Bij kamertemperatuur strekt het PNIPAM-polymeer zich naar buiten uit, maar stort in zodra lichaamstemperatuur, 37 graden Celsius, is bereikt, waardoor de lading van het medicijnmolecuul van het nanodeeltje kan ontsnappen.
Halverwege elke polymeerarm, het team installeerde een zwavel-zwavelbinding. Wanneer de deeltjes een cel binnenkomen, ze voldoen aan hoge niveaus van glutathion, een molecuul dat zwavel-zwavelbindingen splitst. Zo wordt de buitenste polymeerlaag van het nanodeeltje afgeknipt, en het medicijn komt nog sneller vrij.
Toen het team dit effect testte met een middel tegen kanker genaamd doxorubicine, het dual-action effect was duidelijk. "De verandering van kamertemperatuur naar lichaamstemperatuur, en het effect van glutathion, toonde synergetische en snelle afgifte van het medicijn, " zegt Li. Bij lagere temperaturen, of bij afwezigheid van glutathion, geneesmiddelafgifte was aanzienlijk langzamer, hij zegt.
"Het volgende plan is om nieuwe functionaliteit te integreren, voor nauwkeurige afgifte van het medicijn voor gerichte kankertherapie, ", zegt Li. Het ene uiteinde van elke Y-vormige tak kan worden gefunctionaliseerd met een molecuul dat selectief aan kankercellen hecht, het medicijn precies daar afleveren waar het nodig is.
 The Penguins of the Tundra Biome
The Penguins of the Tundra Biome  Soorten fossielen en hoe ze zijn gevormd
Soorten fossielen en hoe ze zijn gevormd Thoreaus grote inzicht voor het Antropoceen:Wildheid is een houding, geen plaats
Thoreaus grote inzicht voor het Antropoceen:Wildheid is een houding, geen plaats Veranderingen in de sneeuwbedekking bedreigen de biodiversiteit van de Arctische natuur
Veranderingen in de sneeuwbedekking bedreigen de biodiversiteit van de Arctische natuur Climate reality check:wereldwijde koolstofvervuiling in 2018 gestegen
Climate reality check:wereldwijde koolstofvervuiling in 2018 gestegen
Hoofdlijnen
- Gymnospermen: definitie, levenscyclus, typen en voorbeelden
- Lood visgerei kan een bedreiging vormen voor de populaties van duikers
- Hoe kunnen nieuwe cellen iemands gezichtsvermogen herstellen?
- Voorbeelden van hittebestendige bacteriën
- Unieke manieren om een DNA-model te bouwen
- De vogels van een meedogenloos paradijs
- S-fase: wat gebeurt er tijdens deze subfase van de celcyclus?
- Onderzoek biedt inzichten voor de bestrijding van verwoestende amfibieënziekte
- Diepe wortels in planten aangedreven door bodemhydrologie
- Nanokristalkatalysator zet onzuivere waterstof om in elektriciteit
- Optische nanoantenne met hoge bitrate ontwikkeld voor gebruik met optische golfgeleider

- Zilvernanodeeltjesconcentratie te laag om schadelijk te zijn in de watervoorziening, papieren vondsten
- Chemici creëren de ultieme natuurlijke zonnebrandcrème

- Tweedimensionale metalen openen wegen naar nieuwe wetenschap

 Er was eens in een onweersbui
Er was eens in een onweersbui Hoe genoctrooien werken
Hoe genoctrooien werken  Wat veroorzaakt een lager vriespunt?
Wat veroorzaakt een lager vriespunt?  Anisotrope plasmonen in quasi-metalen 2-D materialen
Anisotrope plasmonen in quasi-metalen 2-D materialen Ruimtestation weer op volle kracht, SpaceX wordt begin vrijdag gelanceerd
Ruimtestation weer op volle kracht, SpaceX wordt begin vrijdag gelanceerd 8 beroemde parken ontworpen door Frederick Law Olmsted,
8 beroemde parken ontworpen door Frederick Law Olmsted,  Record CO2-uitstoot voor Arctische bosbranden:EU
Record CO2-uitstoot voor Arctische bosbranden:EU Onder het noorderlicht:uitputting van de mesosferische ozonlaag uitgelegd
Onder het noorderlicht:uitputting van de mesosferische ozonlaag uitgelegd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

