
Wetenschap
Een taps toelopend siliciumgat kan leiden tot betere medicijntesten
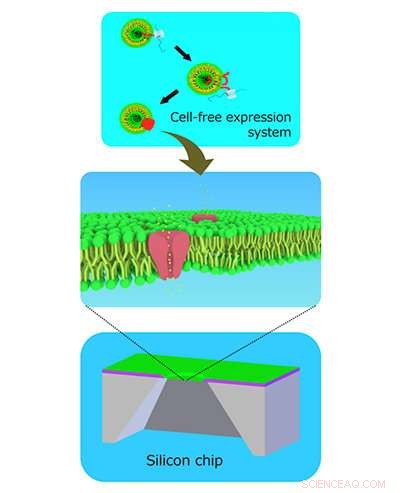
Celvrije ionenkanalen ingebed in dubbellaagse lipidemembranen gevormd in siliciumchips. Krediet:Ayumi Hirano-Iwata
Tohoku University-onderzoekers hebben de momenteel beschikbare methoden voor het screenen van medicijnen op hartgerelateerde bijwerkingen verbeterd.
De methode omvat het vervaardigen van een klein gaatje in een siliciumchip waarover lipidemembranen, vergelijkbaar met die rond de cellen, worden aangemoedigd om te groeien. Een ionkanaal wordt vervolgens afzonderlijk gesynthetiseerd en tijdens het centrifugeren in het membraan geslagen.
Ionenkanalen zijn poriën gemaakt van eiwitten die in sommige celmembranen voorkomen, zoals in hartspiercellen. Ze openen en sluiten om ionen door te laten, het creëren van een elektrisch signaal. Sommige medicijnen hebben bijwerkingen doordat ze op deze ionkanalen inwerken. Het antihistaminicum astemizol, bijvoorbeeld, die nu van de Amerikaanse markt is gehaald, kan een kaliumionkanaal afsluiten dat betrokken is bij het reguleren van de hartslag. Inname ervan kan leiden tot onregelmatige hartkloppingen.
Wetenschappers hebben manieren onderzocht om medicijnen te screenen op bijwerkingen op ionkanalen. De momenteel beschikbare methoden zijn onvolmaakt. In één methode, stamcellen zijn gericht om te transformeren in hartspiercellen die het specifieke type ionenkanaal hebben dat wordt gebruikt voor het testen van geneesmiddelen. Deze methode, echter, is vervelend en kan tot 90 dagen voorbereiding vergen. Ander, minder tijdrovende methoden omvatten het inbrengen van ionenkanalen in kunstmatig gevormde lipidemembranen die een klein gaatje bedekken dat is gemaakt in een micro- of nano-chip. Maar de huidige methoden leiden tot de vorming van onstabiele membranen, het verminderen van hun efficiëntie tijdens experimenten.
Professor Ayumi Hirano-Iwata van het Advanced Institute of Materials Research van Tohoku University en haar team fabriceerden drie siliciumchips met verschillend gevormde gaten en vergeleken hun vermogen om ionkanaalbevattende lipidemembranen te hosten.
Elke chip was gemaakt van een dikke laag silicium bedekt met een dunne laag siliciumnitride, gevolgd door een dunne laag siliciumoxide. In een reeks stappen, het centrale deel van de chip werd weggeëtst om een klein gaatje te creëren. De vorm van het gat varieerde zeer licht, afhankelijk van het type zuur dat werd gebruikt om het materiaal op te lossen. Het team ontdekte dat het gat dat de meeste stabiliteit bood voor de vorming van lipidemembranen, een geleidelijk taps toelopende rand had. Een groter percentage membranen bleef tijdens het centrifugeren aan de taps toelopende rand vastzitten (45 procent) en wanneer er kleine krachten op werden uitgeoefend (75 procent), vergeleken met die aan de twee andere gaten (van 0 procent tot 20 procent).
Het team voegde een celvrij gesynthetiseerd hartspierionkanaal toe, genaamd hERG, door centrifugeren naar de membranen. Ze slaagden erin elektrische stromen van de kanalen te detecteren en de stromen te blokkeren door het medicijn astemizol toe te dienen, die een algemeen erkend nadelig effect heeft op hERG-kanalen in het hart.
Hun aanpak heeft het potentieel "om te dienen als een nieuw screeningplatform voor het beoordelen van de potentiële risico's van bijwerkingen van geneesmiddelen die werken op hERG-kanalen van patiënten, " concluderen de onderzoekers in hun studie gepubliceerd in het tijdschrift Wetenschappelijke rapporten .
 De meest invloedrijke klimaatwetenschappelijke paper aller tijden
De meest invloedrijke klimaatwetenschappelijke paper aller tijden Pauwen worden vermoord door welke soorten dieren?
Pauwen worden vermoord door welke soorten dieren?  Strandbouw zorgt ervoor dat de Atlantische kust niet ten onder gaat
Strandbouw zorgt ervoor dat de Atlantische kust niet ten onder gaat Wat zijn de natuurlijke rijkdommen van het loofbos?
Wat zijn de natuurlijke rijkdommen van het loofbos?  Een biljoen bomen niet genoeg om de klimaatcrisis op te lossen, critici zeggen:
Een biljoen bomen niet genoeg om de klimaatcrisis op te lossen, critici zeggen:
Hoofdlijnen
- Dolfijnen slaan mensen, chimpansees bij vroege tekenen van zelfbewustzijn
- Twee neuropeptiden in zebravissen geven aanwijzingen voor de complexe neurale mechanismen die ten grondslag liggen aan slaap
- Dominant Allele: wat is het? & Waarom gebeurt het? "(with Traits Chart)
- Detectorhonden bieden hoop om numbats te redden
- Waarom verplaatsen chloroplasten zich in Elodea?
- Your Body On: A Horror Movie
- Het verschil tussen craniologie en frenologie
Craniologie en frenologie zijn beide praktijken die de conformatie van de menselijke schedel onderzoeken; echter, de twee zijn heel verschillend. Craniologie is de studie van verschillen in vorm, groott
- Simpele microscoopexperimenten
- Studie lost waarom drinken je de munchies geeft
- Materiaaloppervlak bootst natuurlijke antimicrobiële oppervlakken na door bacteriële cellen te binden en open te breken

- Uitgebreide beoordeling van heterogeen geïntegreerde 2D-materialen

- DNA-nanogieterijen gieten op maat gemaakte 3D metalen nanodeeltjes

- Nieuwe sensor voor SERS Raman-spectroscopie bijna net zo gevoelig als de neus van een hond

- Onderzoekers creëren kunstmatige eiwitten om de assemblage van buckyballs te controleren

 Catalyst Advance verbetert de technologie voor het reinigen van aardgas
Catalyst Advance verbetert de technologie voor het reinigen van aardgas Indonesië sluit 30 bedrijven af vanwege bosbranden
Indonesië sluit 30 bedrijven af vanwege bosbranden Wetenschappers betreden onontgonnen terrein bij zoektocht naar supergeleiding
Wetenschappers betreden onontgonnen terrein bij zoektocht naar supergeleiding Grindtypes
Grindtypes  In een kwantumrace is iedereen zowel een winnaar als een verliezer
In een kwantumrace is iedereen zowel een winnaar als een verliezer Koralen sterven als opwarming van de aarde botst met lokaal weer in de Zuid-Chinese Zee
Koralen sterven als opwarming van de aarde botst met lokaal weer in de Zuid-Chinese Zee Verzuring van de oceaan veroorzaakt osteoporose van koraal op iconische riffen
Verzuring van de oceaan veroorzaakt osteoporose van koraal op iconische riffen Ontdekking van elektrokatalysatoren versnellen
Ontdekking van elektrokatalysatoren versnellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

