
Wetenschap
Nanomachines in bacteriën assembleren
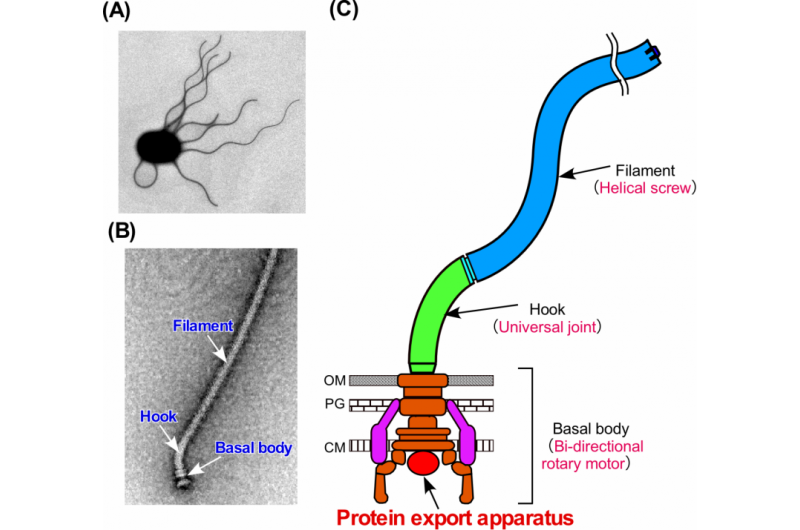
Figuur 1. Het bacteriële flagellum. (A) Elektronenmicrofoto van een Salmonella-cel. (B) Elektronenmicrofoto van de Salmonella flagellum. (C) Schematisch diagram van het flagellum. Het flagellum bestaat uit ten minste drie delen:het basale lichaam als een bidirectionele roterende motor, de haak als kruiskoppeling en het filament als spiraalschroef. Krediet:Universiteit van Osaka
Onderzoekers van de Universiteit van Osaka gebruiken röntgenkristallografie en elektronenmicroscopie om de assemblage van het exportpoortapparaat in Salmonella op te lossen. De nieuwe details van deze nanomachine zullen naar verwachting verduidelijken hoe bacteriën eukaryote cellen infecteren en nieuwe moleculaire doelen presenteren voor het ontdekken van geneesmiddelen.
Een van de oudste nanomachines in de biologie is het bacteriële flagellum. Dit apparaat is evolutionair essentieel, waardoor bacteriën het vermogen krijgen om te bewegen. Het flagellum vertoont grote gelijkenis met een andere bacteriële structuur, het injectisoom, wat, zoals de naam al aangeeft, is hoe sommige bacteriën hun inhoud afleveren om een gastheer te infecteren. Een nieuwe studie door onderzoekers van de Universiteit van Osaka onthult hoe een specifieke structuur in flagellum en injectisoom, het exportpoortcomplex, dynamisch assembleert en hoe het voorkomen van deze assemblage bacteriën onschadelijk kan maken. Het onderzoek is te zien in PLOS Biologie .
Universitair hoofddocent Tohru Minamino aan de Graduate School of Frontier Biosciences bestudeert al jaren het exportpoortcomplex met behulp van elektronenmicroscopie. Zijn interesse in dit complex ligt vooral bij de engineering van nieuwe nanomachines, maar hij realiseerde zich dat hetzelfde onderzoek medische implicaties zou kunnen hebben.
"Er zijn veel structurele en functionele overeenkomsten tussen de flagellaire en injectisome-eiwitten. Ze zouden goede doelen kunnen zijn voor het remmen van bacteriële infectie, " hij zei.

Figuur 2. Model voor de FliP-ringstructuur. FlipP vormt een homohexameer. Het FliO-complex fungeert als een scaffold om aan FliP te binden om de vorming van FliP-ringen te vergemakkelijken. Krediet:Universiteit van Osaka
Het exportcomplex in Salmonella flagellum bestaat uit vijf transmembraaneiwitten. Deze zullen achtereenvolgens samenkomen om de exportpoort te vormen, beginnend met het eiwit FlipP. Aangenomen wordt dat de exportpoort in Salmonella-injectisoom op dezelfde manier wordt samengesteld met behulp van vijf homologe eiwitten. Minamino laat zien dat hoewel het geen deel uitmaakt van de poortstructuur, een zesde transmembraaneiwit, FliO, is essentieel om met de montage van de poort te beginnen.
"FliO fungeert als een steiger voor FliP om een ringstructuur te vormen. Zonder deze ring, de andere transmembraaneiwitten zullen niet volgen in het poortcomplex, " hij zei.
Elektronenmicroscopiebeelden gaven aan dat de FliO-steiger ervoor zorgt dat FliP een hexameer vormt, waardoor volgende transmembraaneiwitten zich bij de assemblage kunnen voegen. Elektrostatische berekeningen identificeerden welke specifieke aminozuren in FliP cruciaal waren voor de FliO-FliP-interacties en de FliP-FliP-interacties, het verstrekken van kandidaat-doelen voor experimentele geneesmiddelen. Om aan te tonen dat FliO nodig is voor de assemblage van de exportpoort en niet voor de structuur, Minamino toonde aan dat de overexpressie van FliP het FliO-defect kan omzeilen en doorgaan met het voltooien van het exportgate-apparaat.
Hoewel FliO FliP in staat stelt een hexameer te vormen, het FliP homologe eiwit in het injectisoom, SpaP, vormt een pentemeer en een hetero-hexameer samen met SpaR, het FliR homologe eiwit. Computeranalyse suggereerde dat FliP ook deze structuur zou kunnen aannemen.
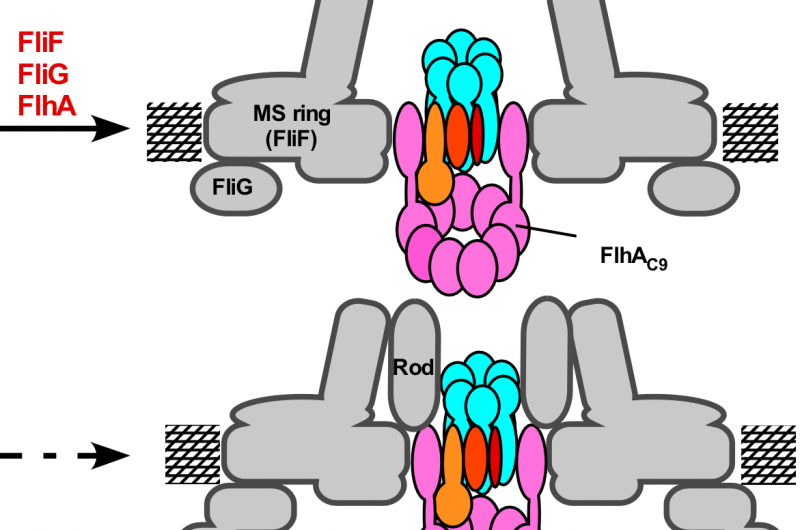
Figuur 3. Model voor het assemblageproces van het flagellaire exportapparaat. De montage van het exportgate-complex begint met FliP-ringvorming met behulp van het FliO-complex, gevolgd door de montage van FliQ, FliR, en FlhB en tenslotte van FlhA tijdens MS-ringvorming in het cytoplasmatische membraan. Na voltooiing van de C-ringstructuur, het cytoplasmatische ATPase-ringcomplex wordt gevormd aan de flagellaire basis, waardoor exportsubstraten in de centrale holte van het FliP-ringcomplex kunnen gaan. Krediet:Universiteit van Osaka
"Een aanzienlijk aantal van de FliP-ringdeeltjes die we hebben geanalyseerd, kan worden toegewezen aan 5-voudige rotatieanalyse, zodat ze pentameren konden vormen. We zijn ervan overtuigd dat FliP een goed model is voor SpaP, ' zei Minamino.
Identificatie van de eerste stap voor de montage van de exportpoort, namelijk de oligomerisatie van FliP door FliO-interacties, suggereert een mogelijke manier om de pathologie van bacteriën zoals Salmonella te verstoren.
"Onze bevindingen suggereren dat FliP-homologen van het injectisoom veelbelovende medicijndoelen zijn, ' zei Minamino.
 Nieuwe studie onderzoekt de passage van geknoopt DNA door nanoporiën
Nieuwe studie onderzoekt de passage van geknoopt DNA door nanoporiën Levens-emulerende moleculen vertonen een basismetabolisme
Levens-emulerende moleculen vertonen een basismetabolisme Nieuwe tool verandert het spel voor heterogene materiaalmodellering
Nieuwe tool verandert het spel voor heterogene materiaalmodellering Wetenschappers hebben een alternatief gevonden voor waterchlorering
Wetenschappers hebben een alternatief gevonden voor waterchlorering Triplex-signaal chemosensor voor detectie met het blote oog en spectrometrische lead
Triplex-signaal chemosensor voor detectie met het blote oog en spectrometrische lead
 Synthetische smaragden maken
Synthetische smaragden maken  Puerto Rico staat voor een lange weg naar een duurzame toekomst
Puerto Rico staat voor een lange weg naar een duurzame toekomst Israël kan de komende jaren een zware aardbeving van 6,5 op de schaal van Richter verwachten
Israël kan de komende jaren een zware aardbeving van 6,5 op de schaal van Richter verwachten Biden stopt met leasen van fossiele brandstoffen op federaal land
Biden stopt met leasen van fossiele brandstoffen op federaal land Duizenden vluchten voor uitbarstende Filipijnse vulkaan
Duizenden vluchten voor uitbarstende Filipijnse vulkaan
Hoofdlijnen
- Vertaling (biologie): definitie, stappen, diagram
- Het verschil tussen histon en nonhistone
- Hoe werkt ruw ER met Ribosomes?
- Parasitisme: definitie, types, feiten en voorbeelden
- Onderzoek onthult hoe cellen zich herbouwen na mitose
- Colombia,
- Sardines nemen ons mee naar de bronnen van biodiversiteit in de Amazone-rivier
- Mitosis: definitie, stadia en doel
- Onderzoekers schijnen de schijnwerpers op illegale handel in wilde orchideeën
- Genetische algoritmen gebruiken om nieuwe nanogestructureerde materialen te ontdekken
- Magnetische nanotags spotten kanker bij muizen eerder dan methoden die nu klinisch worden gebruikt

- Geneesmiddelen met nanodeeltjes kunnen het voor medicijnen gemakkelijker maken om hun doelen te bereiken

- Verstijving van de ruggengraat van DNA-nanovezels

- Gestructureerd oppervlak kan het vermogen van dunne siliciumzonnecellen verhogen

 Astronomenkaart onthult locatie van mysterieus snel bewegend gas
Astronomenkaart onthult locatie van mysterieus snel bewegend gas Wat zijn de voordelen van het behoud van fossiele brandstoffen?
Wat zijn de voordelen van het behoud van fossiele brandstoffen?  Afbeelding:Vesuvius in brand
Afbeelding:Vesuvius in brand De implicaties van kosmische stilte
De implicaties van kosmische stilte Houston overstroomt vervuilde riffen meer dan 100 mijl uit de kust
Houston overstroomt vervuilde riffen meer dan 100 mijl uit de kust Een van 's werelds snelste camera's legt beweging van elektronen vast
Een van 's werelds snelste camera's legt beweging van elektronen vast In de geest van een hacker:psychologische profielen van cybercriminelen
In de geest van een hacker:psychologische profielen van cybercriminelen Schimmelmicroben als biomeststoffen in landbouw en tuinieren:is de beloning groter dan het risico?
Schimmelmicroben als biomeststoffen in landbouw en tuinieren:is de beloning groter dan het risico?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

