
Wetenschap
Wat is nanogeneeskunde, en hoe kan het de behandeling van kinderkanker verbeteren?
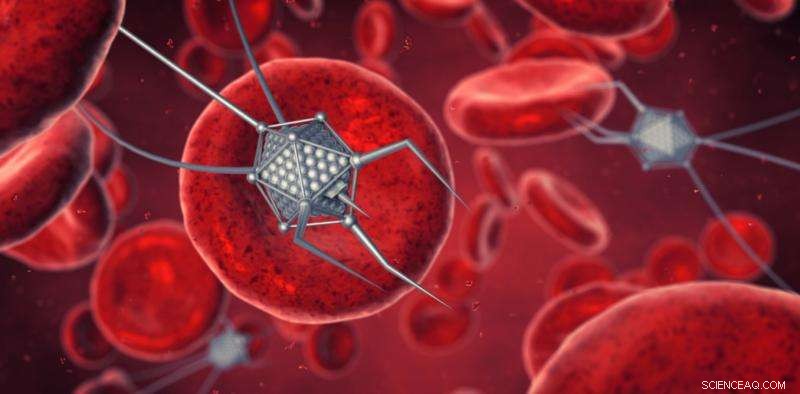
Therapieën op nanoschaal zijn gebaseerd op gemanipuleerde nanodeeltjes die zijn ontworpen om medicijnen te verpakken en precies daar af te leveren waar ze nodig zijn. Krediet:shutterstock.com
Een recent Amerikaans onderzoek van mensen die als kind voor kanker werden behandeld, van de jaren zeventig tot 1999, toonde aan dat hoewel de overlevingskansen in de loop der jaren zijn verbeterd, de kwaliteit van leven voor overlevenden is laag. Het toonde ook aan dat dit erger was voor degenen die in de jaren negentig werden behandeld.
Ongeveer 70% van de overlevenden van kinderkanker ervaart bijwerkingen van hun behandeling, inclusief secundaire kankers. En naarmate de overlevingskansen verbeteren, de wereldwijde populatie van overlevenden van kinderkanker groeit.
Bijwerkingen veroorzaken stress voor overlevenden en gezinnen en verhogen de vraag naar gezondheidssystemen. Maar een opkomend gebied van de geneeskunde, nanogeneeskunde, biedt hoop op een betere behandeling van kinderkanker die minder bijwerkingen zal hebben en de kwaliteit van leven van de overlevenden zal verbeteren.
Wat is nanogeneeskunde?
Nanogeneeskunde is de toepassing van nanomaterialen, of nanodeeltjes, naar de geneeskunde. Nanodeeltjes zijn een vorm van transport voor drugs en kunnen naar plaatsen gaan waar medicijnen zelf niet heen zouden kunnen gaan.
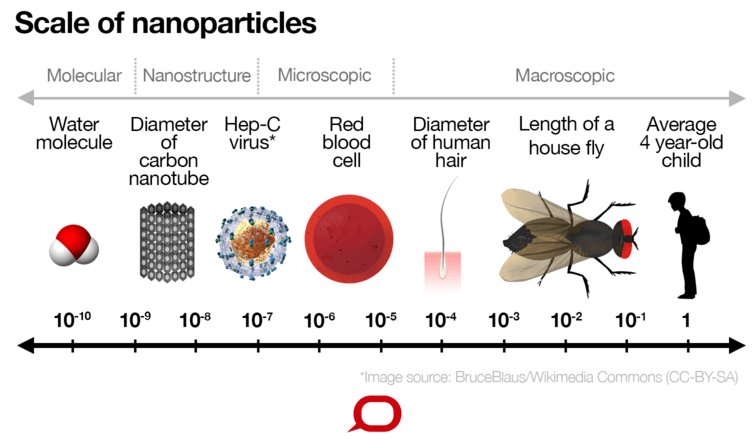
Nano betekent klein. Een nanometer (nm) is een miljardste van een meter. Nanodeeltjes die worden gebruikt voor medicijnafgifte liggen meestal in het bereik van 20 tot 100 nanometer, hoewel dit kan variëren afhankelijk van het ontwerp van het nanodeeltje.
Nanodeeltjes kunnen worden ontwikkeld en ontworpen om medicijnen rechtstreeks te verpakken en te transporteren naar de plaats waar ze nodig zijn. Deze gerichte aanpak betekent dat de medicijnen de meeste schade aanrichten in de specifieke, en bedoeld, gebied van de tumor waar ze worden afgeleverd. Dit minimaliseert nevenschade aan omliggende gezonde weefsels, en dus de bijwerkingen.
Het eerste kankernanomedicijn dat werd goedgekeurd door de Amerikaanse Food and Drug Administration was Doxil. Sinds 1995, het is gebruikt voor de behandeling van kanker bij volwassenen, waaronder eierstokkanker, multipel myeloom en Karposi-sarcoom (een zeldzame vorm van kanker die vaak voorkomt bij mensen met een immuundeficiëntie, zoals hiv en aids).
Momenteel, er is een stroom van nieuwe behandelingen met nanomedicijnen voor kanker bij volwassenen in klinische onderzoeken (onderzoeken bij mensen), of op de markt. Maar slechts een beperkt aantal hiervan is goedgekeurd voor kinderkanker, hoewel dit aantoonbaar is waar de sterke punten van nanogeneeskunde het meeste voordeel kunnen hebben.
Hoe werkt nanogeneeskunde?
De medicijnafgiftesystemen voor nanodeeltjes kunnen op verschillende manieren werken. Samen met het dragen van het medicijn voor aflevering, nanodeeltjes kunnen worden gemanipuleerd om specifieke verbindingen te dragen waardoor ze kunnen binden, of hechten, aan moleculen op tumorcellen. Eenmaal bevestigd, ze kunnen het medicijn veilig op de specifieke tumorplaats afleveren.
Nanodeeltjes kunnen ook helpen bij de oplosbaarheid van geneesmiddelen. Om een medicijn te laten werken, het moet in de bloedbaan kunnen komen, wat betekent dat het oplosbaar moet zijn. Bijvoorbeeld, het kankergeneesmiddel paclitaxel (Taxol) is onoplosbaar en moet dus worden opgelost in een toedieningsmiddel om in het bloed te komen. Maar dit middel kan allergische reacties veroorzaken bij patiënten.
Om deze problemen op te lossen, scheikundigen hebben een nanodeeltje ontwikkeld uit het natuurlijk voorkomende eiwit albumine. Het draagt de paclitaxel en maakt het oplosbaar maar zonder allergische reacties.
Tumoren hebben gewoonlijk ongeordende en lekkende bloedvaten die er doorheen en eraf ontspruiten. Deze bloedvaten zorgen ervoor dat chemotherapiemedicijnen gemakkelijk de tumor kunnen binnendringen, maar omdat chemotherapiemoleculen zo klein zijn, ze diffunderen ook door de bloedvaten en uit de tumor, omliggende weefsels aanvallen. Nanodeeltjes zijn grotere moleculen die vast komen te zitten in de tumor, waar ze alle schade aanrichten.
Zodra ze hun drugslading bij de cellen hebben afgeleverd, nanodeeltjes kunnen zo worden ontworpen dat ze worden afgebroken tot onschadelijke bijproducten. Dit is vooral belangrijk voor kinderen die zich nog aan het ontwikkelen zijn.
Soorten nanodeeltjes
Nanodeeltjes variëren in kenmerken zoals vorm en grootte. Onderzoekers moeten het juiste nanodeeltje matchen met het medicijn dat het moet afleveren en de specifieke tumor.
Een reeks nanodeeltjesstructuren wordt momenteel ontwikkeld. Een voorbeeld van een interessante structuur is de vorm van een DNA-origami. Omdat DNA een biologisch materiaal is, nanodeeltjes die in DNA-origami-vormen zijn gemanipuleerd, zullen door het immuunsysteem niet als vreemd worden gezien. Dus deze kunnen een medicijn naar zieke cellen transporteren terwijl ze het immuunsysteem van het lichaam ontwijken, waardoor de bijwerkingen van medicijnen worden verminderd.
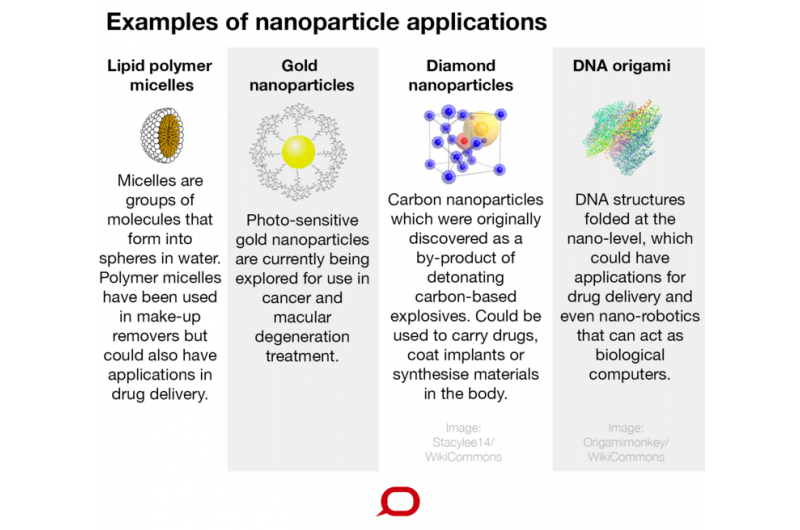
Een ander voorbeeld van nanogeneeskundige structuren zijn polymere nanodragers. We hebben onlangs een gen geïdentificeerd dat de groei van tumoren bevordert, kankerverspreiding en resistentie tegen chemotherapie bij alvleesklierkanker.
We gebruikten een nanomedicijn genaamd een polymere nanodrager en combineerden het met een medicijn dat het kankergen tot zwijgen brengt. We hebben dit verpakt tot een nanomedicijn en de medicijnen in de tumor afgeleverd.
Deze nanomedicijnen verminderden de expressie van het kankergen, blokkeerde de tumorgroei en verminderde de verspreiding van alvleesklierkanker. Maar we toonden ook aan dat polymere nanocarriers in het lab gecombineerd kunnen worden met andere gene-silencing drugs. Dit betekent dat de methode kan worden gebruikt voor een reeks andere op genen gebaseerde kankers.
Hoe kunnen nanomedicijnen helpen bij de behandeling van kanker bij kinderen?
Bij de standaardbehandeling voor kinderkanker, geneesmiddelen voor chemotherapie worden vaak voorgeschreven in de maximaal aanvaardbare dosis voor de leeftijd of grootte van een kind, gebaseerd op doseringen voor volwassenen. Maar kinderen zijn geen kleine volwassenen. De processen die ten grondslag liggen aan de groei en ontwikkeling van kinderen kunnen leiden tot een ander effect en een andere respons op een chemotherapiemedicijn dat niet bij volwassenen wordt gezien.
Ook, als een kind resistent wordt tegen een medicijn en ze de maximaal toelaatbare dosis gebruiken, er is geen ruimte om het te verhogen zonder giftige bijwerkingen. Door medicijnen in te pakken en ze rechtstreeks door het lichaam naar zieke cellen te verplaatsen om bijkomende schade te verminderen, in theorie, nanomedicine maakt het gebruik van hogere doses medicijnen mogelijk.
Nanogeneeskunde heeft een groot potentieel om kinderkanker veilig te behandelen. Echter, het wordt momenteel gedwarsboomd door te weinig onderzoek. Ongeveer tweederde van de onderzoeksaandacht in therapeutische nanomedicijnen, van meer 250 nanomedicijnproducten, is gericht op kanker. Toch vertaalt dit zich niet in nieuwe kankerbehandelingen voor kinderen die op de markt komen.
Maar we boeken vooruitgang. Ons werk onderzoekt het ontwerp van nanodeeltjes om gene-silencing medicijnen te leveren voor de behandeling van de meest voorkomende hersenkanker bij kinderen - medulloblastoom.
We werken ook aan nanomedicijnen voor andere belangrijke vormen van kanker bij kinderen. Deze omvatten geneesmiddel-refractaire acute lymfoblastische leukemie, de meest voorkomende kinderkanker, en neuroblastoom, de kanker die meer levens eist van mensen onder de vijf dan alle andere.
Dit artikel is oorspronkelijk gepubliceerd op The Conversation. Lees het originele artikel. 
 Nieuwe techniek maakt gebruik van sjablonen om zelfvouwende 3D-structuren te begeleiden
Nieuwe techniek maakt gebruik van sjablonen om zelfvouwende 3D-structuren te begeleiden Wat gebeurt er met de pH van water als HCI wordt toegevoegd?
Wat gebeurt er met de pH van water als HCI wordt toegevoegd?  De stof van wandeluitrusting heeft een verkoelend effect dat uw volgende smartwatch comfortabeler kan maken
De stof van wandeluitrusting heeft een verkoelend effect dat uw volgende smartwatch comfortabeler kan maken Nieuwe materialen vertonen een gespleten persoonlijkheid
Nieuwe materialen vertonen een gespleten persoonlijkheid De drie fasen van fotosynthese
De drie fasen van fotosynthese
 Onderzoekers ontdekken nieuwe rol voor stikstofmonoxide
Onderzoekers ontdekken nieuwe rol voor stikstofmonoxide Habitat van duizendpoten
Habitat van duizendpoten NASA-satellieten laten zien hoe wolken reageren op veranderingen in het Arctische zee-ijs
NASA-satellieten laten zien hoe wolken reageren op veranderingen in het Arctische zee-ijs Welke dieren zijn bosdieren?
Welke dieren zijn bosdieren?  Studie onthult hoe grote droogtes in de Grotere Mekong leiden tot uitbarstingen van kooldioxide-emissies
Studie onthult hoe grote droogtes in de Grotere Mekong leiden tot uitbarstingen van kooldioxide-emissies
Hoofdlijnen
- Lijst met celorganellen en hun functies
- Wetenschappers ontdekken een genetisch mechanisme dat het opbrengstpotentieel van graangewassen zou kunnen verbeteren
- Nieuwe ontdekking om de ontwikkeling van zouttolerante wijnstokken te versnellen
- Wat zijn de vier organische moleculen in levende dingen?
- Structurele niveaus van organisatie van het menselijk lichaam
- Genetische studie onderzoekt manieren om de productiviteit en malsheid van vlees te verhogen
- Controversiële onkruidverdelger houdt EU in de knoop (Update)
- Virussen bestrijden:codebrekers worden codeschrijvers
- 7 soorten bindweefsel
- Protonen voeden de vooruitzichten voor grafeen

- Lang en smal, vrij van gebreken, en oplosbaar:grafeen nanoribbons door bottom-up synthese
- Met nanokristallen gecoate vezels kunnen verspilde energie verminderen

- Nanodeeltjes geladen met een component van gewone kruiden doden kankercellen
- Nanodeeltjes misleiden lichaam om orgaantransplantaties te accepteren
 Eukaryoten vereisen zuurstof?
Eukaryoten vereisen zuurstof?  Mannen de hoogste risicogroep voor vuurwapenverwondingen en overlijden
Mannen de hoogste risicogroep voor vuurwapenverwondingen en overlijden De gevaren van biohacking-experimenten - en hoe het uw gezondheid kan schaden
De gevaren van biohacking-experimenten - en hoe het uw gezondheid kan schaden Waar wordt de kern in de cel gevonden en waarom?
Waar wordt de kern in de cel gevonden en waarom?  Vlindervormig palladium subnano cluster gebouwd in 3-D
Vlindervormig palladium subnano cluster gebouwd in 3-D Mythes over het metrieke stelsel doorbreken
Mythes over het metrieke stelsel doorbreken Socioloog ziet milieusteun wegglippen onder democratische presidenten
Socioloog ziet milieusteun wegglippen onder democratische presidenten De verrassende achteruitgang van ondernemerschap en innovatie in het Westen
De verrassende achteruitgang van ondernemerschap en innovatie in het Westen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

