
Wetenschap
Onderzoekers gebruiken nanoscopische poriën om eiwitstructuur te onderzoeken
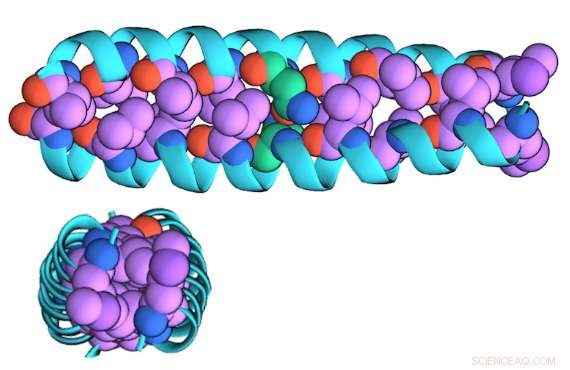
Een illustratie van de "gezipte" dimeervorm van GCN4-p1 gezien vanaf de zijkant (boven) en boven (onder)
Onderzoekers van de Universiteit van Pennsylvania hebben vooruitgang geboekt in de richting van een nieuwe methode voor het sequencen van genen waarbij een streng van DNA-basen wordt afgelezen terwijl ze door een nanoscopisch gaatje worden geregen.
In een nieuwe studie, ze hebben aangetoond dat deze techniek ook kan worden toegepast op eiwitten om meer te weten te komen over hun structuur.
Bestaande methoden voor dit soort analyse zijn arbeidsintensief, typisch met zich meebrengen van de verzameling van grote hoeveelheden van het eiwit. Ze vereisen ook vaak een aanpassing van het eiwit, het beperken van het nut van deze methoden voor het begrijpen van het gedrag van het eiwit in zijn natuurlijke staat.
De translocatietechniek van de Penn-onderzoekers maakt de studie van individuele eiwitten mogelijk zonder ze te wijzigen. Monsters genomen van een enkel individu kunnen op deze manier worden geanalyseerd, het openen van aanvragen voor ziektediagnostiek en onderzoek.
Het onderzoek werd geleid door Marija Drndić, een professor in het departement Natuur- en Sterrenkunde van de School of Arts &Sciences; David Niedzwiecki, een postdoctoraal onderzoeker in haar lab; en Jeffery G. Saven, een professor in de scheikunde van Penn Arts &Sciences.
Het werd gepubliceerd in het tijdschrift ACS Nano .
De techniek van het Penn-team komt voort uit het werk van Drndić aan nanopore-gensequencing, die tot doel heeft de basen in een DNA-streng te onderscheiden door het verschillende percentage van de opening die ze elk blokkeren als ze door een nanoscopische porie gaan. Verschillende silhouetten laten verschillende hoeveelheden van een ionische vloeistof door. De verandering in ionenstroom wordt gemeten door elektronica rond de porie; de pieken en dalen van dat signaal kunnen worden gecorreleerd aan elke basis.
Terwijl onderzoekers werken aan het verhogen van de nauwkeurigheid van deze metingen tot bruikbare niveaus, Drndić en haar collega's hebben geëxperimenteerd met het toepassen van de techniek op andere biologische moleculen en nanoschaalstructuren.
Samenwerken met de groep van Saven, ze wilden hun poriën testen op nog lastiger biologische moleculen.
"Er zijn veel eiwitten die veel kleiner en moeilijker te manipuleren zijn dan een DNA-streng die we willen bestuderen, Saven zei. "We zijn geïnteresseerd in het leren over de structuur van een bepaald eiwit, zoals of het bestaat als een monomeer, of gecombineerd met een ander exemplaar tot een dimeer, of een aggregaat van meerdere kopieën bekend als een oligomeer."
Detectie is ook vaak een beperking.
"Er zijn geen manieren om peptiden en eiwitten te amplificeren zoals voor DNA, "Zei Drndić. "Als je eiwitten uit een bepaalde bron wilt bestuderen, je zit vast met hele kleine steekproeven. Met deze methode, echter, je kunt gewoon de hoeveelheid gegevens verzamelen die je nodig hebt en het aantal eiwitten dat je door de porie wilt laten gaan en ze dan een voor een bestuderen omdat ze van nature in het lichaam voorkomen."
Met behulp van de siliciumnitride-nanoporiën van de Drndić-groep, die op aangepaste diameters kunnen worden geboord, het onderzoeksteam ging hun techniek testen op GCN4-p1, een eiwit dat is geselecteerd omdat het een gemeenschappelijk structureel motief bevat dat wordt aangetroffen in transcriptiefactoren en intracellulaire receptoren.
"De dimere versie is aan elkaar 'geritst', " Niedzwiecki zei, "Het is een 'opgerolde spoel' van verweven helices die ruwweg cilindrisch is. De monomeerversie is opengeritst en is waarschijnlijk niet spiraalvormig, het is waarschijnlijk meer een touwtje."
De onderzoekers stopten verschillende verhoudingen van geritste en uitgepakte versies van het eiwit in een ionische vloeistof en leidden ze door de poriën. Hoewel ze het verschil tussen individuele eiwitten niet kunnen zien, de onderzoekers zouden deze analyse kunnen uitvoeren op populaties van het molecuul.
"De dimeer- en monomeervorm van het eiwit blokkeren een ander aantal ionen, dus we zien een andere stroomafname als ze door de porie gaan, " zei Niedzwiecki. "Maar we krijgen een reeks waarden voor beide, omdat niet elke moleculaire translocatie-gebeurtenis hetzelfde is."
Bepalen of een specifiek monster van dit soort eiwitten aggregeert of niet, zou kunnen worden gebruikt om de progressie van de ziekte beter te begrijpen.
"Veel onderzoekers, "Save zei, "hebben deze lange kluwens van geaggregeerde peptiden en eiwitten waargenomen bij ziekten zoals Alzheimer en Parkinson, maar er is steeds meer bewijs dat suggereert dat deze kluwens zich achteraf voordoen, dat wat het probleem echt veroorzaakt, kleinere eiwitassemblages zijn. Uitzoeken wat die assemblages zijn en hoe groot ze zijn, is momenteel erg moeilijk om te doen, dus dit kan een manier zijn om dat probleem op te lossen."
 NOAA's GOES-16 klaar om voorspellingen nog meer te verbeteren
NOAA's GOES-16 klaar om voorspellingen nog meer te verbeteren Oekraïne opent gigantische koepel boven verwoeste reactor van Tsjernobyl
Oekraïne opent gigantische koepel boven verwoeste reactor van Tsjernobyl Hoe wrijving evolueert tijdens een aardbeving
Hoe wrijving evolueert tijdens een aardbeving Vragen dwarrelen over Portugal brandt weg des doods
Vragen dwarrelen over Portugal brandt weg des doods Nieuw classificatiesysteem voor mineralen legt het complexe verleden van de aarde vast
Nieuw classificatiesysteem voor mineralen legt het complexe verleden van de aarde vast
Hoofdlijnen
- "DNA Model Project Ideas
- Wat is een endotherme reactie?
- Biologische leeftijd verklaart variatie in reacties op stress
- Hoe het boren naar olie in het Arctic National Wildlife Refuge van invloed kan zijn op dieren in het wild
- Do All Cells Have Mitochondria?
- Vijf soorten aseksuele reproductie
- Hoe zijn genen, DNA en chromosomen met elkaar verbonden?
- Top 5 onopgeloste hersenmysteries
- Wanneer is de beste tijd van de dag om een beslissing te nemen?
- Nanotechnologie inspireert tandheelkundige materialen van de volgende generatie
- Naar een beter begrip van dubbellaags grafeen

- Nieuwe ijzeroxide-nanodeeltjes kunnen een zeldzame bijwerking helpen voorkomen die wordt veroorzaakt door huidige contrastmiddelen voor MRI

- Getemperde groeitechniek produceert grafeen nanoribbons met metaalachtige eigenschappen

- Een duidelijk pad naar betere inzichten in biomoleculen

 Het wateroppervlak is een fantastische plek voor chemische reacties
Het wateroppervlak is een fantastische plek voor chemische reacties Slaap kan ooggetuigen helpen bij het kiezen van onschuldige verdachten
Slaap kan ooggetuigen helpen bij het kiezen van onschuldige verdachten De dichtheid van een oplossing berekenen
De dichtheid van een oplossing berekenen Het internet energiezuiniger maken door systemische optimalisatie
Het internet energiezuiniger maken door systemische optimalisatie De erosie van de permafrost in Siberië verslechtert al jaren
De erosie van de permafrost in Siberië verslechtert al jaren Hoe de massa van een Cube
Hoe de massa van een Cube Duivelse bron van stof in atmosfeer van aarde en Mars
Duivelse bron van stof in atmosfeer van aarde en Mars VK onthult energieprijsplafond om 11 miljoen huishoudens te helpen
VK onthult energieprijsplafond om 11 miljoen huishoudens te helpen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

