
Wetenschap
De twee ontmoeten elkaar eindelijk:nanodraden en nanobuisjes gecombineerd om intracellulaire bio-elektronische sondes te vormen
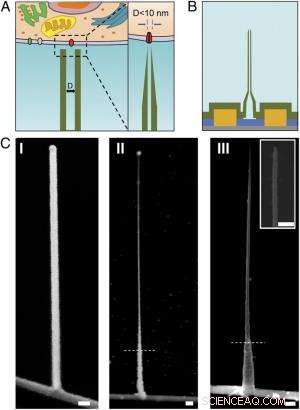
Schema's en SEM-afbeeldingen van de ultrakleine BIT-FET. ( EEN ) Schematische illustratie van een intracellulaire bio-elektronische sonde. ( Links ) Algemeen schema van een sonde voor opname van intracellulaire elektrofysiologie. ( Rechts ) Een vergroot beeld van de punt van een sub-10-nm bio-elektronische sonde en de bijbehorende grootte met een enkel ionenkanaal. ( B ) Schematische structuur van de ultrakleine BIT-FET. Groente, geel, blauw, en grijze kleuren vertegenwoordigen SiO 2 laag, metalen contact, SiNW, en siliciumnitridesubstraat, respectievelijk. ( C ) SEM-afbeeldingen van de ultrakleine BITFET bij verschillende fabricagestappen. Bovenop SiNW werd eerst een GeNW-tak gekweekt ( l ), gevolgd door een volgende H 2 O 2 etsen van het bovenste deel van GeNW om de diameter te verkleinen tot een regime van minder dan 10 nm ( II ). Een laatste beeld van een ultrakleine BIT-FET met nanobuis-ID ∼8 nm, en SiO 2 wanddikte ∼10 nm wordt weergegeven in ( III ). inzet van III is de close-up van de punt van de ultrakleine SiO 2 nanobuis. Witte stippellijnen in II en III geef het punt aan waaronder de GeNW en SiO 2 wordt beschermd door fotoresist tijdens H 2 O 2 en BHF etsen, respectievelijk. Alle schaalbalken:100 nm. Krediet:Copyright © PNAS, doi:10.1073/pnas.1323389111
(Phys.org) — Geminiaturiseerde bio-elektronische sondes zullen biologie en geneeskunde transformeren door meting van intracellulaire componenten mogelijk te maken in vivo . Onlangs, wetenschappers van Harvard University en Peking University ontwierpen, gefabriceerde en gedemonstreerde bio-elektronische sondes zo klein als 5 nanometer met behulp van een unieke driedimensionale nanodraad-nanobuis heterostructuur. (Een heterostructuur combineert meerdere heterojuncties - interfaces tussen twee lagen of regio's van ongelijke kristallijne halfgeleider - in een enkel apparaat.) Door experimentele metingen en numerieke simulaties, de onderzoekers toonden aan dat deze apparaten voldoende tijdsresolutie hebben om de snelste elektrische signalen in neuronen en andere cellen op te nemen, met integratie in grotere chiparrays die mogelijk ultrahoge resolutie mapping van activiteit in neurale netwerken en andere biocellulaire systemen mogelijk maken.
Prof. Xiaojie Duan besprak het artikel dat zij, Afgestudeerd onderzoeker Tian-Ming Fu, Prof. Charles M. Lieber en hun co-auteurs gepubliceerd in: Proceedings van de National Academy of Sciences . Ze wijst er eerst op dat nanobuissondes en hun heterojunctie met silicium nanodraad-veldeffecttransistoren (SiNW FET's) mechanisch minder stabiel worden naarmate de diameter kleiner wordt. "Als de nanobuis kleiner en kleiner wordt, "Duan vertelt Phys.org, "het wordt gemakkelijker om de nanobuis te breken bij het verbindingsgebied met de SiNW. Bij de toepassing van het gebruik van de sonde voor intracellulaire bio-elektronische detectie, er zullen verschillende krachten zijn, zoals de capillaire kracht van de vloeistof, evenals interactie tussen de sonde en het celmembraan. Deze krachten kunnen de sonde breken als we een zwakke verbinding hebben tussen de sonde en het SiNW."
Een ander probleem is dat de elektrische gevoeligheid ook wordt verminderd naarmate de diameter van de nanobuisjes afneemt, omdat de binnendiameter van de nanobuis (ID) het effectieve poortgebied van het apparaat definieert. "Bij het opnemen van intracellulair transmembraanpotentieel met behulp van onze sonde, " legt Duan uit, "cytosol vult de nanobuis en fungeert als de poortelektrode voor de onderliggende SiNW FET." Cytosol (ook wel genoemd) intracellulaire vloeistof of cytoplasmatische matrix ) is de vloeistof die in cellen wordt gevonden, met uitzondering van organellen en andere cytoplasmatische componenten. "De cytosolpotentiaalverandering moduleert de dragerdichtheid van de SiNW FET, waardoor de geleiding verandert, "Duan gaat verder. "Dit is hoe onze sonde werkt voor bio-elektronica-opnames." Het contactgebied tussen het cytosol en het SiNW - gedefinieerd door de binnendiameter van de nanobuis - bepaalt de effectiviteit van de geleidingsmodulatie. Met andere woorden, als de binnendiameter van de nanobuis te klein is, het SiNW FET-poortgebied zal ook te klein zijn.
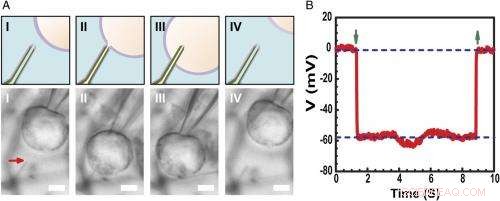
Intracellulaire rustmembraanpotentiaalopname. ( EEN ) Schema's (bovenste) en differentiële interferentiecontrast optische microscopiebeelden ( Lager ) van een HL-1-cel gemanipuleerd door een glazen micropipet om ( l ), contact ( II ), doordringen ( III ), en terugtrekken ( NS ) van een fosfolipide-gemodificeerde ultrakleine BITFET-sonde. De rode pijl geeft de positie van de ultrakleine nanobuistip aan. Omdat pure SiO 2 nanobuis is optisch transparant, de GeNW-sjabloon van dit apparaat is niet geëtst voor beeldvorming. Schaalbalk:2 m. ( B ) Representatieve elektrische opnameresultaten van een ultraklein BIT-FET-apparaat met 10 nm ID; in dit geval, de GeNW werd geëtst om de ultrakleine SiO . op te leveren 2 nanobuis. Naar beneden en naar boven wijzende groene pijlen markeren het begin van celpenetratie en -terugtrekking, respectievelijk. De bovenste en onderste horizontale stippellijnen geven de extracellulaire en intracellulaire mogelijkheden aan. Quasi-statische waterpoortmetingen uitgevoerd voor/na celmetingen laten een verandering van <2% zien in de geleidbaarheid en gevoeligheid van het apparaat. Krediet:Copyright © PNAS, doi:10.1073/pnas.1323389111
De onderzoekers kregen ook het feit te zien dat hoogfrequente dynamische respons kan verslechteren met afnemende binnendiameter van de nanobuis als gevolg van toenemende oplossingsweerstand in de nanobuis. "Als de binnendiameter van de nanobuis kleiner wordt, " legt Duan uit, "de weerstand van de oplossing in de nanobuis zal toenemen, vanwege de afname van de doorsnede van de oplossingsgeleider." Bovendien, de snelheid waarmee de onderliggende SiNW FET kan reageren op een signaal wordt bepaald door het product RC van de capaciteit en de weerstand van de oplossingsgeleider in de nanobuis - dus als de nanobuis kleiner wordt, de weerstand wordt groter. Dit betekent dat de SiNW FET meer tijd nodig heeft om te reageren - en als de signaalverandering te snel is, de sonde zal het niet betrouwbaar kunnen opnemen. "Dat is wat we bedoelen met 'hoogfrequente dynamische respons zal afnemen met afnemende binnendiameter van nanobuisjes, ', voegt Duan toe, "Echter, we vonden dat voor onze sonde, zelfs als we de binnendiameter van de nanobuis verkleinen tot 5 nm, de sonde kan nog steeds een 3 kHz-signaal getrouw opnemen - een bandbreedte die in de meeste gevallen voldoende is voor het opnemen van neurale en cardiale signalen."
De onderzoekers werden ook geconfronteerd met de noodzaak om actieve halfgeleider-nanodraad-veldeffecttransistordetectoren te gebruiken om de beperkingen van het verkleinen van de sondegrootte te overwinnen. 'Het woord actief' wordt vergeleken met het 'passieve' karakter van opnemen met metalen elektroden, Duan wijst erop. "Voor het opnemen van metalen elektrodes, a portion of the transmembrane potential V m will be dropped or lost at the electrode/electrolyte interface, so the signal recorded will be smaller than the real transmembrane potential." When the size of the metal electrode is reduced, the impedance value at the electrode/electrolyte will increase – and at some point, this impedance will get so large that the recorded signal will be obscured by noise. Echter, for the FET recording, the cytosol potential change is reflected by the semiconductor channel conductance change, which is independent of the probe/electrolyte interface impedance. "Since decrease in probe size will therefore niet affect the signal amplitude, " Duan adds, "using the FET to sense potential is a very effective way to overcome the limitations of probe-size reduction."
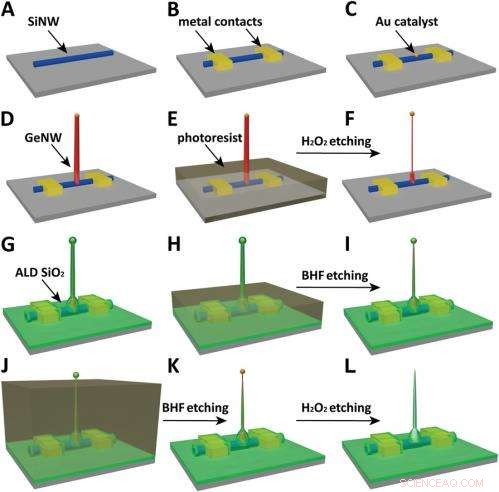
Schematics of the fabrication flow for the ultrasmall BIT-FET. ( EEN ) SiNWs (blue) are dispersed on substrate (solid gray). ( B ) S/D contacts are defined by EBL followed by thermal evaporation. ( C ) Au nanodots are defined on SiNWs between S/D using EBL and thermal evaporation. ( NS ) GeNWs (red) are grown on top of the SiNWs through nanocluster-catalyzed CVD process. ( E ) A thin layer of photoresist (transparent gray) is spin coated on the chip to protect the lower GeNW part. ( F ) The resulting H 2 O 2 -etched GeNWs following photoresist liftoff. Only the GeNW above the photoresist in E is thinned by etching in H 2 O 2 . (G) SiO 2 is conformally deposited over the entire chip by ALD. ( H ) A thin layer of photoresist (transparent gray) is spin coated to protect the lower region of chip. ( l ) The resulting BHF etched structures following liftoff. The region of SiO 2 above the photoresist layer in H is etched to ca.10-nm thickness. ( J ) Photoresist with thickness smaller than the GeNW heights is deposited. ( K ) The resulting structure following BHF etching of SiO2, which exposes the tips of the GeNWs. Isotopic BHF etching yields a small taper with thinner SiO 2 at the topmost part of the structure. (L) The GeNW is removed by H 2 O 2 etching to form an ultrasmall nanotube connected to the bottom SiNW FET. Copyright © PNAS, doi:10.1073/pnas.1323389111
Another critical challenge was synthetically integrating nanotubes and nanowires. "The nanotube is made of silicon oxide and the nanowire is made of silicon, " Du an notes. "For cell recording, the nanotube needs to be built vertically onto the nanowires – meaning that a three-dimensional heterostructure is needed." While the heterostructure could be fabricated in various ways, not all of them provided the required controllability at the probe scale. Daarom, the researchers grew a germanium nanowire (GeNW) on top of the silicon nanowires, with the GeNW acting as a template for the nanotube. "Depositing SiO 2 on the GeNW/SiNW heterostructure, then selectively removing the core GeNW, resulted in the desired nanotube/SiNW structure, " notes Duan. "Using this method, the nanotube inner diameter can be controlled by the GeNW diameter, the outer diameter can be controlled by the SiO 2 thickness, and the nanotube length can be defined by the GeNW growth time. This gives us complete and easily implemented control over the probe's dimensions."
Eindelijk, the scientists had to investigate and model the bandwidth effect of phospholipid coatings, which are important for intracellular recording. "We use phospholipid coating to assist the nanotube probe to penetrate the cell membrane, " Duan notes. "Since the bandwidth of our probe is important for the probe to be able to record fast neural or cardiac signal, we need to make sure this phospholipid modification will not overly affect the bandwidth." Because the phospholipid layer will decrease the cross section of the solution conductor inside the nanotube, it impacts bandwidth in two ways by changing the capacitance and resistance of the solution inside the nanotube. (The phospholipid-modified probe bandwidth is easily determined by applying a fast artificial signal to the solution, and then recording how the conductance of the device changes over time. This provides the time the device needs to respond to this signal and thus the device's bandwidth.) "Therefore, " Duan explains, "if the nanotube is large, this thin phospholipid layer will not cause too much of a difference. Echter, for our probe, the sub-10 nm nanotube size is almost the same scale as the lipid layer – so we have to carefully examine how it affects probe bandwidth, both experimentally and theoretically."
The scientists addressed these myriad challenges in designing, fabriceren, and demonstrating the probe with three key innovations. "The first is the use of FET as potential sensing element, which in principle enables us to overcome the size limit on the probe." Duan explains. "However, FETs have conventionally existed in a linear geometry with connections that preclude access to the inside of cells." The second innovation was the solution to this problem – namely, the design of a vertical SiO 2 nanotube on top of the nanoscale FET, which allowed them to introduce cytosol into the cell without having to insert the FET channel inside the cell, which would be more invasive. The third key is the design of a relatively large nanotube base with a much sharper nanotube tip, resulting in a sub-10 nm probe without sacrificing its mechanical strength and electrical sensitivity.
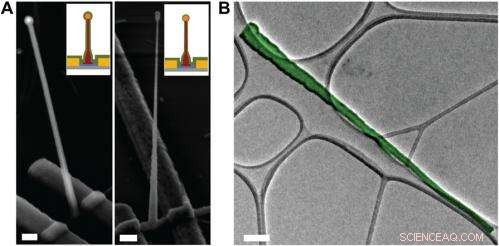
Electron microscopy characterization of the ultrasmall BIT-FET. ( EEN ) Representative SEM (Zeiss Ultra Plus field-emission SEM) images of intermediate fabrication steps of the ultrasmall BIT-FET. ( Left ) Device after 30-nm ALD coating of SiO 2 . ( Rechts ) Device after first step of selective BHF etching of the upper80% portion of the SiO 2 to ca. 10 nm (Fig. S1 H en l ). White dashed lines in l en II indicate the point below which the SiO 2 is protected by photoresist during BHF etching. Scale bars:200 nm. ( B ) False-colored transmission electron microscopy (JEOL 2100 TEM) image of an ultrasmall nanotube. This tube was fabricated following the same procedure as described in SI Text , and deposited onto lacey carbon grids (Ted Pella) from ethanol suspension. It has a tip ID ∼7 nm and bottom ID ∼80 nm. False color is used here to distinguish the SiO 2 nanotube from background amorphous carbon. Scale bar:50 nm. Credit:Copyright © PNAS, doi:10.1073/pnas.1323389111
An important aspect of the study was ensuring that the bioelectronic devices had sufficient time resolution to record the fastest electrical signals in neurons and other cells. "The signals in neural system are normally in the millisecond scale, " Duan points out. "That means that to reliably record these signals, the recording device needs to have a bandwidth measure in kilohertz." While the probe's bandwidth decreases with the decrease of nanotube diameter, the scientists found that even for probes with inner diameters as small as 5 nm, the bandwidth is still around 3 kHz (a time resolution ~ 0.3 ms) in physiological solution. "This means that our probes have sufficient time resolution to record the fastest electrical signals in neurons and other cells, " Duan adds.
Bovendien, Duan points out, the scientists found that measuring the cell transmembrane resting potential with these ultrasmall bioelectronic devices demonstrates the capability for intracellular electrophysiology studies. "When we measured the transmembrane resting potential of HL-1 cell with our new probes, we found that with the phospholipid modification, the nanotube can easily and reliably penetrate the cell membrane, allowing the FET to record the intracellular transmembrane potential at full amplitude." After retracting the nanotube from the cell, the recorded potential can immediately revert to the extracellular potential. "Reliable cell membrane penetration and stable recording of intracellular transmembrane potential prove the capability of our probes for intracellular electrophysiology studies, " notes Duan.
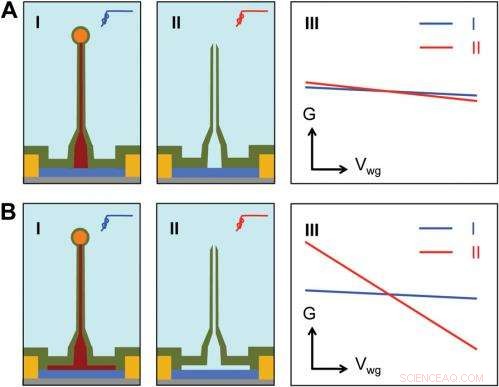
Sensitivity of different device structures. ( EEN , B ) Schematics of the ultrasmall BIT-FET without and with Ge overcoating on the SiNW, respectievelijk. l en II correspond to the BIT-FET devices before and after Ge core etching. III show schematically typical conductance ( G ) vs. water-gate (V wg ) measurements from these distinct structures. Credit:Copyright © PNAS, doi:10.1073/pnas.1323389111
Vooruit gaan, says Duan, the researchers' are planning to scale up their work to integrate the probes into high-density, large-scale array for large-scale mapping of neural activities; use the probes to record neural signals from small subcellular structures/organelles; and investigate other applications in which the probes will provide substantially greater spatial resolution and minimal invasiveness than other techniques.
In aanvulling, the scientists might consider developing other innovations. "Bijvoorbeeld, " Duan illustrates, "a major challenge in using our ultra-small probes for recording from small subcellular structures is to accurately position them with respect to the subcellular structures of interest. We're looking at either labeling our probe with fluorescence dye – or other biocompatible materials – to mark the nanotube at high resolution, or using specific targeting in which the probe's biochemical surface groups define the specific cell location being studied."
Duan sees other areas of research that might benefit from their study, inclusief:
- Neuroscience:Since recording of intracellular action potential and other low frequency transmembrane potential signal is important to study the neural network.
- Medicine:By studying how the drugs affect the recorded intracellular action potentials or other transmembrane potentials, the probes can provide an attractive technique for parallel or high-throughput screening of drugs targeting the ion channels.
- Biophysics:The process of cell membrane penetration by the phospholipid-modified nanotube can serve as a useful platform for studying the cell membrane's fusion-related biological processes.
© 2014 Fysio.org. Alle rechten voorbehouden.
 Controle over de productie van stabiele aerogels
Controle over de productie van stabiele aerogels Nieuw, gevoeliger sensor voor het evalueren van de veiligheid van geneesmiddelen
Nieuw, gevoeliger sensor voor het evalueren van de veiligheid van geneesmiddelen Onderzoekers ontwikkelen katalysator die het Z-schema van fotosynthese nabootst
Onderzoekers ontwikkelen katalysator die het Z-schema van fotosynthese nabootst High-speed FM-AFM en simulatie onthullen atomaire oplossingsprocessen van calciet in water
High-speed FM-AFM en simulatie onthullen atomaire oplossingsprocessen van calciet in water Iowas Winter Cold Temperature History
Iowas Winter Cold Temperature History
Hoofdlijnen
- Het verschil tussen rode en witte bloedcellen
- Wetenschapper duikt in honderden onderwatergrotten op zoek naar nieuwe vormen van leven
- Onderzoek werpt nieuw licht op hoe organismen energie gebruiken in een menigte
- Waarom heeft een regenworm een gesloten bloedsomloop?
- Signaaltransductie: definitie, functie, voorbeelden
- Er zit een diepere vis in de zee
- Science Fair Project Ideas: Equine
- Middelgrote carnivoren lopen het grootste risico door veranderingen in het milieu
- Studie van zeedieren suggereert dat het zenuwstelsel meerdere keren onafhankelijk is geëvolueerd
- Draadloos vermogen voor de prijs van een cent

- Nieuwe methode ontwerpt nanomaterialen met een precisie van minder dan 10 nanometer

- Diamanten schitteren in energieopslagoplossing

- Zachte röntgenmethode belooft nanocarrier-doorbraken voor slimme medicijnen

- Samengevoegde nanodriehoeken effenen de weg naar magnetische koolstofmaterialen

 Een onwaarschijnlijke concurrent voor diamant als beste warmtegeleider
Een onwaarschijnlijke concurrent voor diamant als beste warmtegeleider Het vergroten van de boombedekking kan een superfood zijn voor de geestelijke gezondheid van de gemeenschap
Het vergroten van de boombedekking kan een superfood zijn voor de geestelijke gezondheid van de gemeenschap ANU-astronomen maken de beste kaart van de zuidelijke hemel
ANU-astronomen maken de beste kaart van de zuidelijke hemel Wat maakt bodem, bodem? Onderzoekers vinden verborgen aanwijzingen in DNA
Wat maakt bodem, bodem? Onderzoekers vinden verborgen aanwijzingen in DNA Onderzoekers onthullen de universele eigenschappen van actieve turbulentie
Onderzoekers onthullen de universele eigenschappen van actieve turbulentie Een nieuwe stralingsdetector gemaakt van grafeen
Een nieuwe stralingsdetector gemaakt van grafeen De voordelen - en mogelijke valkuilen - van stedelijk groen
De voordelen - en mogelijke valkuilen - van stedelijk groen Een model voor loopbaanadviseurs om werkloosheid aan te pakken na de COVID-19-pandemie
Een model voor loopbaanadviseurs om werkloosheid aan te pakken na de COVID-19-pandemie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

