
Wetenschap
Multitasking plasmonische nanobellen doden sommige cellen, anderen wijzigen
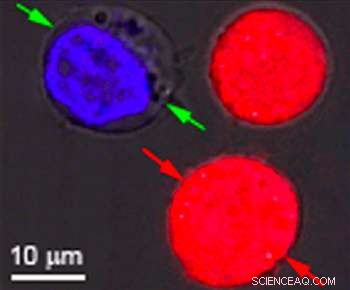
Identieke cellen die rood en blauw gekleurd waren, waren het doelwit van onderzoek aan de Rice University om het effect van plasmonische nanobellen aan te tonen. De bubbels vormen rond verwarmde gouden nanodeeltjes die zich richten op bepaalde cellen, zoals kankercellen. Als de deeltjes hol zijn, er vormen zich bellen die groot genoeg zijn om de cel te doden wanneer ze barsten. Als de deeltjes vast zijn, de bubbels zijn kleiner en kunnen een tijdelijk gat in een celwand slaan, medicijnen of ander materiaal naar binnen laten stromen. Beide effecten kunnen gelijktijdig worden bereikt met een enkele laserpuls. Krediet:Plasmonic Nanobubble Lab/Rice University
(Phys.org)—Onderzoekers van de Rice University hebben een manier gevonden om sommige zieke cellen te doden en tegelijkertijd andere in hetzelfde monster te behandelen. Het proces dat wordt geactiveerd door een puls van laserlicht laat aangrenzende gezonde cellen onaangeroerd.
Het unieke gebruik van afstembare plasmonische nanobellen, ontwikkeld in het Rice-lab van Dmitri Lapotko, belooft veel goeds om verschillende moeilijke processen te vervangen die nu worden gebruikt om kankerpatiënten te behandelen. onder andere, met een snelle, eenvoudig, multifunctionele werkwijze.
Het onderzoek staat centraal in een artikel dat deze week online is gepubliceerd door het tijdschrift American Chemical Society ACS Nano en werd uitgevoerd in Rice door Lapotko, onderzoekswetenschapper en hoofdauteur Ekaterina Lukianova-Hleb en student Martin Matonga, met hulp van het Centrum voor Cel- en Gentherapie van het Baylor College of Medicine (BCM), Texas Children's Hospital en het MD Anderson Cancer Center van de Universiteit van Texas.
Plasmonische nanobellen van 10, 000 keer kleiner dan een mensenhaar veroorzaken kleine explosies. De bellen vormen zich rond plasmonische gouden nanodeeltjes die opwarmen wanneer ze worden geëxciteerd door een externe energiebron - in dit geval een korte laserpuls – en verdamp een dunne laag vloeistof nabij het oppervlak van het deeltje. De dampbel zet snel uit en stort in. Lapotko en zijn collega's hadden al ontdekt dat plasmonische nanobellen kankercellen doden door ze letterlijk te laten exploderen zonder schade aan gezonde buren, een proces dat een veel hogere precisie en selectiviteit vertoonde in vergelijking met die gemedieerd door alleen gouden nanodeeltjes, hij zei.
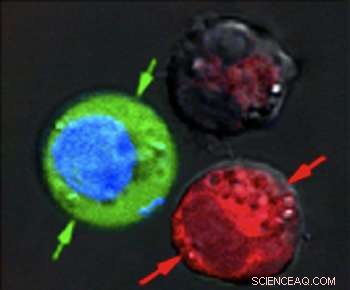
Na de laserpuls, roodgekleurde cellen vertonen bewijs van enorme schade door exploderende nanobellen, terwijl blauwgekleurde cellen intact bleven, maar met groene fluorescerende kleurstof van buiten naar binnen getrokken. Krediet:Plasmonic Nanobubble Lab/Rice University
Het nieuwe project gaat nog een paar stappen verder met dat opmerkelijke vermogen. Een reeks experimenten heeft aangetoond dat een enkele laserpuls grote plasmonische nanobellen creëert rond holle gouden nanoschillen, en deze grote nanobellen vernietigen selectief ongewenste cellen. Dezelfde laserpuls creëert kleinere nanobellen rond massief gouden nanobolletjes die een kleine, tijdelijke porie in de wand van een cel en creëert een binnenkomende nanojet die snel medicijnen of genen in de andere cellen "injecteert".
In hun experimenten, Lapotko en zijn team plaatsten 60 nanometer brede holle nanoschillen in modelkankercellen en kleurden ze rood. In een aparte batch, ze stopten nanosferen van 60 nanometer in hetzelfde type cellen en kleurden ze blauw.
Nadat de cellen aan elkaar zijn gesuspendeerd in een groene fluorescerende kleurstof, ze vuurden een enkele brede laserpuls af op het gecombineerde monster, waste de groene vlek uit en controleerde de cellen onder een microscoop. De rode cellen met de holle nanoschillen werden uit elkaar geblazen door grote plasmonische nanobellen. De blauwe cellen waren intact, maar groengekleurde vloeistof van buitenaf was de cellen in getrokken waar kleinere plasmonische nanobellen rond de massief gouden nanodeeltjes tijdelijk de wanden openwrikten.
Omdat dit allemaal in een fractie van een seconde gebeurt, maar liefst 10 miljard cellen per minuut kunnen selectief worden verwerkt in een doorstroomsysteem zoals dat in ontwikkeling is bij Rice, zei Lapotko, een faculteitsgenoot in biochemie en celbiologie en in natuurkunde en sterrenkunde. Dat heeft potentieel om cel- en gentherapie en beenmergtransplantatie te bevorderen, hij zei.
De meeste ziektebestrijdende cel- en gentherapieën vereisen "ex vivo" - buiten het lichaam - verwerking van menselijke celtransplantaten om ongewenste (zoals kankerachtige) cellen te elimineren en om andere cellen genetisch te modificeren om hun therapeutische efficiëntie te verhogen, zei Lapotko. "Huidige celverwerking is vaak traag, duur en arbeidsintensief en lijdt aan hoge celverliezen en slechte selectiviteit. Idealiter zouden zowel eliminatie als transfectie (de introductie van materialen in cellen) zeer efficiënt moeten zijn, selectief, snel en veilig."
Plasmonische nanobubble-technologie belooft "een methode om meerdere dingen tegelijkertijd met een celpopulatie te doen, " zei Malcolm Brenner, hoogleraar geneeskunde en kindergeneeskunde aan BCM en directeur van BCM's Centrum voor Cel- en Gentherapie, die samenwerkt met het Rice-team. "Bijvoorbeeld, als ik iets in een stamcel wil stoppen om er een ander type cel van te maken, en tegelijkertijd de omliggende cellen doden die het potentieel hebben om schade aan te richten wanneer ze teruggaan in een patiënt - of in een andere patiënt - deze zeer afstembare plasmonische nanobellen hebben het potentieel om dat te doen."
De langetermijndoelstelling van een samenwerking tussen Rice, BCM, Texas Children's Hospital en MD Anderson moeten de uitkomst verbeteren voor patiënten met ziekten waarvan de behandeling ex vivo celverwerking vereist, zei Lapotko.
Lapotko is van plan een prototype van de technologie te bouwen met het oog op testen met menselijke cellen in de nabije toekomst. "We willen dat dit een universeel platform wordt voor cel- en gentherapie en voor stamceltransplantatie, " hij zei.
Hoofdlijnen
- Waar bevindt zich DNA in plantencellen?
- Kenmerken van Twins
- Een nieuwe studie toont aan dat mieren voor de verstandigere optie kiezen, zelfs als dat betekent dat je wat harder moet werken
- Dino-dodende asteroïde versnelde evolutie van vogels
- Genetici ontdekken twee verschillende manieren om transcriptie te beëindigen
- Verfijning van pesticiden om ongedierte te doden, geen bijen
- Dansgerelateerde wetenschapsprojecten
- Wat doet ons gapen?
- Wat zijn de verschillen tussen een plant en een dierlijke cel onder een microscoop?
- Chemici tonen aan dat de gefaseerde afgifte van ionen uit goud-zilver nanodeeltjes een nuttige eigenschap kan zijn
- Nieuw curriculum combineert nanotechnologie en skiën (met video)

- Snellere colloïdale fluorescentiestralers:Nanoplatelets
- Houtskool een wapen om door superoxide veroorzaakte ziekten te bestrijden, blessure

- Genetische algoritmen gebruiken om nieuwe nanogestructureerde materialen te ontdekken
 Hoe maak je een 3D-piramide met papier
Hoe maak je een 3D-piramide met papier  Studie onderzoekt verband tussen religie en gelijk loon
Studie onderzoekt verband tussen religie en gelijk loon Een sjabloon voor snelle synthese van nanografenen
Een sjabloon voor snelle synthese van nanografenen Springdruppels krijgen een boost van de zwaartekracht
Springdruppels krijgen een boost van de zwaartekracht Gletsjers in realtime observeren
Gletsjers in realtime observeren Welvaart doodt de planeet, waarschuw wetenschappers
Welvaart doodt de planeet, waarschuw wetenschappers PAINS-killer:studie vindt ernstige problemen met populaire tool voor drugsscreening
PAINS-killer:studie vindt ernstige problemen met populaire tool voor drugsscreening Voorbeelden van katrollen in de dagelijkse levensduur
Voorbeelden van katrollen in de dagelijkse levensduur
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com


