
Wetenschap
Verbeterde nanodeeltjes brengen medicijnen in de hersenen
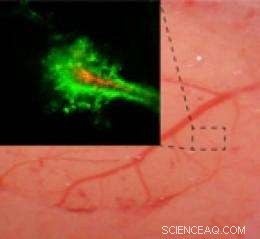
Realtime beeldvorming van een knaagdierhersenen laat zien dat nanodeeltjes gecoat met polyethyleenglycol (PEG) (groen) verder in de hersenen doordringen dan deeltjes zonder de PEG-coating (rood). Krediet:Elizabeth Nance, Graeme Woodworth, Kurt Sailor
De hersenen zijn een notoir moeilijk te behandelen orgaan, maar Johns Hopkins-onderzoekers melden dat ze een stap dichter bij een medicijnafgiftesysteem zijn dat flexibel genoeg is om een aantal belangrijke uitdagingen te overwinnen die worden veroorzaakt door hersenkanker en misschien andere ziekten die dat orgaan aantasten.
In een rapport dat op 29 augustus online is gepubliceerd in Wetenschap Translationele geneeskunde , het Johns Hopkins-team zegt dat zijn bio-ingenieurs nanodeeltjes hebben ontworpen die veilig en voorspelbaar diep in de hersenen kunnen infiltreren wanneer ze worden getest in knaagdieren en menselijk weefsel.
"We zijn blij dat we een manier hebben gevonden om te voorkomen dat in drugs ingebedde deeltjes aan hun omgeving blijven kleven, zodat ze zich kunnen verspreiden zodra ze in de hersenen zijn. " zegt Justin Hanes, doctoraat, Lewis J. Ort hoogleraar Oogheelkunde, met secundaire aanstellingen in chemische en biomoleculaire engineering, biomedische techniek, oncologie, neurologische chirurgie en milieugezondheidswetenschappen, en directeur van het Johns Hopkins Center for Nanomedicine.
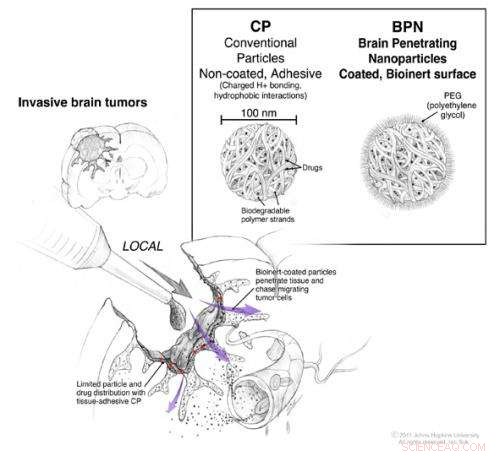
Tijdens een operatie om een hersentumor te verwijderen, directe toegang tot de hersenen en de ruimte tussen de cellen is mogelijk. Conventionele nanodeeltjes met chemotherapeutische medicijnen kunnen tijdens de operatie worden toegepast, maar ze blijven in wezen op het oppervlak waar ze worden aangebracht (rode pijlen). Nanodeeltjes gecoat met voldoende PEG hebben het vermogen om door het weefsel te diffunderen (paarse pijlen) zodat ze kunnen migreren naar de individuele tumorcellen die uit de tumormassa zijn ontsnapt. Krediet:©2011. Johns Hopkins Afdeling Neurochirurgie. Alle rechten voorbehouden. Ian Suk
Na een operatie om een hersentumor te verwijderen, standaard behandelingsprotocollen omvatten de toepassing van chemotherapie rechtstreeks op de operatieplaats om achtergebleven cellen te doden die niet operatief konden worden verwijderd. Daten, deze methode om tumorherhaling te voorkomen is slechts matig succesvol, gedeeltelijk, omdat het moeilijk is om een dosis chemotherapie toe te dienen die hoog genoeg is om voldoende in het weefsel te dringen om effectief te zijn en laag genoeg om veilig te zijn voor de patiënt en gezond weefsel.
Om deze doseringsuitdaging te overwinnen, ingenieurs ontwierpen nanodeeltjes - ongeveer een duizendste van de diameter van een mensenhaar - die het medicijn in kleine, constante hoeveelheden over een bepaalde periode. Conventionele nanodeeltjes voor medicijnafgifte worden gemaakt door medicijnmoleculen samen met microscopische, snaarachtige moleculen in een strakke bal, dat langzaam afbreekt als het in contact komt met water. Volgens Charles Eberhart, MD, een patholoog van Johns Hopkins en een bijdrage aan dit werk, deze nanodeeltjes hebben historisch gezien niet erg goed gewerkt omdat ze aan de cellen op de toedieningsplaats kleven en de neiging hebben om niet dieper in het weefsel te migreren.
Elisabeth Nance, een afgestudeerde student in chemische en biomoleculaire engineering aan Hopkins, en Hopkins neurochirurg Graeme Woodworth, MD, vermoedde dat de penetratie van geneesmiddelen zou kunnen worden verbeterd als de nanodeeltjes van de medicijnafgifte minimaal interageerden met hun omgeving. Nance bekleedde voor het eerst nano-sized plastic kralen van verschillende groottes met een klinisch getest molecuul genaamd PEG, of poly(ethyleenglycol), waarvan door anderen was aangetoond dat ze nanodeeltjes beschermen tegen de afweermechanismen van het lichaam. Het team redeneerde dat een dichte laag PEG de kralen ook gladder zou kunnen maken.
Het team injecteerde vervolgens de gecoate kralen in plakjes knaagdier- en menselijk hersenweefsel. Ze labelden de kralen eerst met gloeiende tags waardoor ze de kralen konden zien terwijl ze door het weefsel bewogen. In vergelijking met niet-PEG-gecoate kralen, of kralen met een minder dichte PEG-coating, ze ontdekten dat een dichte coating van PEG grotere kralen toestond om het weefsel binnen te dringen, zelfs die kralen die bijna twee keer zo groot waren als voorheen werd gedacht dat ze het maximaal mogelijke waren voor penetratie in de hersenen. Ze testten deze kralen vervolgens in levende knaagdierhersenen en vonden dezelfde resultaten.
De onderzoekers namen vervolgens biologisch afbreekbare nanodeeltjes met het chemotherapie-medicijn paclitaxel en bedekten ze met PEG. Zoals verwacht, in hersenweefsel van ratten, nanodeeltjes zonder de PEG-coating bewogen heel weinig, terwijl PEG-bedekte nanodeeltjes zichzelf vrij goed verdeelden.
"Het is echt opwindend dat we nu deeltjes hebben die vijf keer meer drugs kunnen vervoeren, laat het drie keer zo lang los en dringt verder door in de hersenen dan voorheen, ", zegt Nance. "De volgende stap is om te kijken of we tumorgroei of herhaling bij knaagdieren kunnen vertragen." Woodworth voegde eraan toe dat het team "de deeltjes ook wil optimaliseren en ze wil combineren met medicijnen om andere hersenziekten te behandelen, zoals multiple sclerose, hartinfarct, traumatische hersenschade, Alzheimer en Parkinson." Een ander doel voor het team is om hun nanodeeltjes intraveneus toe te kunnen dienen, dat is onderzoek dat ze al zijn begonnen.
 Waardoor ontstaat die piek? Een al lang bestaande vraag over covalente vloeistoffen beantwoorden
Waardoor ontstaat die piek? Een al lang bestaande vraag over covalente vloeistoffen beantwoorden Australische struik bevat nieuwe klasse organische verbindingen
Australische struik bevat nieuwe klasse organische verbindingen Strategie suggereert manieren om zich voor te bereiden op opkomende antibioticaresistente superbacteriën
Strategie suggereert manieren om zich voor te bereiden op opkomende antibioticaresistente superbacteriën Wetenschappers onthullen dubbele specificiteit van Vav2-SH2-eiwit
Wetenschappers onthullen dubbele specificiteit van Vav2-SH2-eiwit Organische kristallen draaien, kromming, en genees
Organische kristallen draaien, kromming, en genees
 El Niño-Zuidelijke Oscillatie-warmtemotor verschuift oostwaarts onder opwarming van de aarde
El Niño-Zuidelijke Oscillatie-warmtemotor verschuift oostwaarts onder opwarming van de aarde Kansen in het voordeel van Greta Thunberg voor de Vredesprijs, maar experts sceptisch
Kansen in het voordeel van Greta Thunberg voor de Vredesprijs, maar experts sceptisch Onderzoekers verbeteren het algoritme dat de hydrologische veranderingen in mediterrane wetlands beschrijft
Onderzoekers verbeteren het algoritme dat de hydrologische veranderingen in mediterrane wetlands beschrijft Wat is een riviervloed?
Wat is een riviervloed?  Science Fair Ideas for Marine Biology
Science Fair Ideas for Marine Biology
Hoofdlijnen
- Ambien
- Een veranderend klimaat, wijn wisselen
- Campylobacter gebruikt andere organismen als Trojaans paard om nieuwe gastheren te infecteren
- Grootte van witrotschimmels verklaard door de breedte van de betrokken genfamilies
- Studie suggereert nieuwe doelen voor het verbeteren van het sojaoliegehalte
- Wat gebeurt er met een Zygote na bevruchting?
- Hoe het Human Microbiome-project werkt
- Onderzoekers brengen het menselijk genoom in 4-D in kaart terwijl het vouwt
- Hoe een celvorm zijn functie beïnvloedt
- Onderzoekers gebruiken nano-klittenbandtechnologie om de opname van circulerende kankercellen te verbeteren

- theoretisch, numerieke studie van grafeenplaten onthult eigenschappen die kunnen leiden tot nieuwe opto-elektrische apparaten

- Nieuwe familie van composietstructuren

- Onderzoekers identificeren buckybowl-structuur
- Verdere details onthuld over een zeer efficiënt medicijnafgiftesysteem tegen kanker
 Oude wesp-nabootsende vlieg uit Zuid-Korea vernoemd naar PSY's Gangnam Style
Oude wesp-nabootsende vlieg uit Zuid-Korea vernoemd naar PSY's Gangnam Style Klimaatverandering bedreigt enkele van 's werelds beste wijnen
Klimaatverandering bedreigt enkele van 's werelds beste wijnen Waarom zijn er verschillende smaken ijzer in het zonnestelsel?
Waarom zijn er verschillende smaken ijzer in het zonnestelsel? De atmosfeer van een nieuwe ultra hete Jupiter wordt geanalyseerd
De atmosfeer van een nieuwe ultra hete Jupiter wordt geanalyseerd Woede stijgt als giftige lucht de hoofdstad van India verstikt
Woede stijgt als giftige lucht de hoofdstad van India verstikt Na twee uur, zonnebrandcrème met zinkoxide verliest effectiviteit, wordt giftig:studeren
Na twee uur, zonnebrandcrème met zinkoxide verliest effectiviteit, wordt giftig:studeren Kwetsbarere mannelijke volwassenen zijn slachtoffer van gedwongen huwelijken dan eerder werd gedacht
Kwetsbarere mannelijke volwassenen zijn slachtoffer van gedwongen huwelijken dan eerder werd gedacht Sydney stapt af van CBD-model
Sydney stapt af van CBD-model
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

