
Wetenschap
Krachten in moleculen kunnen extra lange koolstof-koolstofbindingen versterken
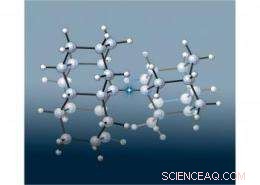
Een team van Europese en SLAC-wetenschappers voegde zich bij twee kleine diamantachtige "diamantvormige" structuren om de langste koolstof-koolstofbinding te creëren (in deze afbeelding gemarkeerd door de ster) ooit gezien in een alkaan, een klasse van moleculen gemaakt van alleen koolstof en waterstof verbonden door enkelvoudige covalente bindingen. Wat was verrassend, echter, was dat het molecuul veel stabieler was dan verwacht, omdat langere bindingen meestal zwakker zijn. De onderzoekers stelden vast dat aantrekkingskrachten tussen de diamandoïden de stabiliteit van dit molecuul verhoogden. Afbeelding door Peter R. Schreiner, Justus-Liebig-universiteit, Duitsland.
(PhysOrg.com) -- De sterkte van een chemische binding tussen atomen is de fundamentele basis voor de stabiliteit en reactiviteit van een molecuul. Het afstemmen van de sterkte en toegankelijkheid van de binding kan de eigenschappen van een molecuul drastisch veranderen. Bijvoorbeeld, de sterkte van een binding is direct gerelateerd aan de lengte:een binding uitrekken tot voorbij zijn normale lengte maakt hem zwakker.
Maar nieuw onderzoek door een team van twee Europese universiteiten en SLAC National Accelerator Laboratory toont aan dat aantrekkingskracht tussen andere delen van een molecuul een uitgerekte binding tussen twee koolstofatomen veel stabieler kan maken dan verwacht. Dit resultaat zou moeten leiden tot verbeteringen in de manier waarop wetenschappers nieuwe moleculen ontwerpen, materialen en katalysatoren.
“We geven inzicht in waarom moleculen met uitzonderlijk lange bindingen niet per se onstabiel hoeven te zijn, " zei Jeremy Dahl, een wetenschapper bij het Stanford Institute for Materials &Energy Science (SIMES), een instituut dat gezamenlijk wordt beheerd door SLAC en Stanford University. Medewerkers waren Peter R. Schreiner van de Justus-Liebig Universiteit in Duitsland en Andrey A. Fokin van het Kiev Polytechnic Institute in de Oekraïne. De resultaten worden vandaag gepubliceerd in Natuur .
Hoewel toepasbaar op alle soorten moleculen, het nieuwe onderzoek omvat alkanen, een klasse van moleculen bestaande uit alleen koolstof- en waterstofatomen verbonden door enkelvoudige covalente bindingen, en diamantoïden, dat zijn diamanten ter grootte van een molecuul die zijn ontwikkeld door SIMES-onderzoekers. ethaan, propaan en octaan zijn bekende alkanen met een ruggengraat van twee, drie en acht koolstofatomen, respectievelijk, allemaal verbonden door enkele bindingen. De koolstofatomen in de extreem stijve diamandoïden zijn gerangschikt in dezelfde tetraëdrische vorm als diamant.
In hun nieuwe onderzoek de wetenschappers sloten zich aan bij paren diamantoïden om drie nieuwe alkanen te creëren met een ultralange koolstof-koolstofbinding in het midden. Om de omvangrijke diamantoïden op te vangen, de centrale binding moest veel verder strekken dan de normale koolstof-koolstofbindingslengte van 1,54 angstrom. (Een angström, of , is een tiende van een nanometer.) Een van de nieuwe moleculen had de langste koolstof-koolstofbinding ooit gemeten in een alkaan:1,704Å.
Verrassend genoeg, deze nieuwe dual-diamondoid moleculen bleken veel stabieler dan verwacht. Eerder onderzoek door andere groepen had aangetoond dat een alkaan met een koolstof-koolstofbinding van 1,65Å minder dan een uur overleefde bij 167C (333F). In tegenstelling tot, de centrale koolstof-koolstofbinding in twee van de nieuwe gekoppelde diamantvormige moleculen brak pas uit elkaar na verhitting boven 300C (572F). De derde, met de 1,704Å koolstof-koolstofbinding, duurde tot het werd verwarmd tot 220C (428F).
“Alleen al op basis van de lengte van de koolstof-koolstofbinding, Ik verwachtte dat deze diamandoïde moleculen veel minder stabiel zouden zijn dan ze bleken te zijn, ', aldus Schreiner. "Er moest iets anders aan de hand zijn dat deze nieuwe moleculen bij elkaar hield."
Wat maakte het verschil? X-ray kristalstructuur, nucleaire magnetische resonantie, en thermogravimetrische studies gemaakt door Dahl's Europese collega's toonden aan dat zelfs als de bindingen uitrekten, aantrekkingskrachten tussen de twee diamantoïden trokken hen dichter bij elkaar. Deze aantrekkingskrachten worden meestal gezien tussen afzonderlijke moleculen, waar ze van der Waals-krachten worden genoemd, naar de Nederlandse natuurkundige die ze voor het eerst beschreef in 1873. “Wetenschappers houden meestal geen rekening met van der Waals-attracties bij het analyseren van de stabiliteit van een enkel molecuul, maar het ziet er nu naar uit dat ze zouden moeten, ' zei Dahl.
De onderzoeksresultaten van de groep werden ondersteund door geavanceerde berekeningen waarmee de wetenschappers de aantrekkende krachten konden in- en uitschakelen wanneer ze de stabiliteit van de nieuwe moleculen evalueerden.
Schreiner voegde eraan toe dat deze bevinding kan verklaren waarom conventionele analyse voorspelt dat vertakte alkanen - die grote groepen atomen aan de alkaanruggengraat bevatten - veel minder stabiel zijn dan ze in werkelijkheid zijn, en waarom diamantoïden veel hogere smeltpunten hebben dan verwacht.
Deze resultaten zijn de laatste in een aantal interessante onderzoeksresultaten en toepassingen voor diamantoïden sinds Dahl en zijn collega Robert Carlson in 2003 een manier ontwikkelden om aanzienlijke hoeveelheden ervan te isoleren uit ruwe olie.
Onder hun interessante eigenschappen, diamantoïden zenden elektronen uiterst efficiënt uit. In werk gepubliceerd in Science in 2007, SIMES-wetenschappers Zhi-Xun Shen, Wanli Yang en Nick Melosh – naast Dahl, Carlson en de Schreiner Group - toonden aan dat diamandoïden gemakkelijk elektronen uitstoten over een zeer smal energiebereik, een eigenschap die de beeldvormingsmogelijkheden van verschillende soorten elektronenmicroscopen zou kunnen verbeteren, evenals elektronenbundelpatronen die worden gebruikt om computerchips te maken.
Diamondoids zijn ook zeer aanpasbaar, wat betekent dat verschillende variëteiten kunnen worden geproduceerd en aangepast om aan verschillende specificaties te voldoen:driedimensionale kristallen voor toepassingen die een poedervormig materiaal vereisen, tweedimensionale films voor het coaten van andere materialen, en mogelijk zelfs eendimensionale nanodraden voor het overbrengen van lading of licht.
“Deze laatste resultaten laten zien dat het maken van moleculen in nieuwe vormen en maten tot verrassende ontdekkingen kan leiden, ' zei Dahl.
 Chemie digitaliseren met een slimme roerstaaf
Chemie digitaliseren met een slimme roerstaaf Bioactief boraatglas op nanoschaal:een materiaal van de volgende generatie voor huidgenezing
Bioactief boraatglas op nanoschaal:een materiaal van de volgende generatie voor huidgenezing Het belang van een periodiek systeem
Het belang van een periodiek systeem  Waterstofenergie maken met het gewone nikkel
Waterstofenergie maken met het gewone nikkel Magneten gebruiken om chemische reacties te beheersen die gericht zijn op de afgifte van medicijnen in het lichaam
Magneten gebruiken om chemische reacties te beheersen die gericht zijn op de afgifte van medicijnen in het lichaam
 Veel Arctische meren stoten minder koolstof uit dan verwacht
Veel Arctische meren stoten minder koolstof uit dan verwacht Klimaatverandering breidt droge gebieden mogelijk niet uit
Klimaatverandering breidt droge gebieden mogelijk niet uit Handelsregels komen naar voren als wapen om klimaatverandering in Europa te bestrijden
Handelsregels komen naar voren als wapen om klimaatverandering in Europa te bestrijden Voorbij de groene revolutie
Voorbij de groene revolutie Nog een gevaarsteken voor koraalriffen:vervangende symbiont schiet tekort
Nog een gevaarsteken voor koraalriffen:vervangende symbiont schiet tekort
Hoofdlijnen
- Oceaanmonumenten worden geconfronteerd met mogelijk verlies van bescherming
- De ontdekking van een mijlpaal verandert de evolutiemarathon in een sprint
- Nieuw algoritme herkent duidelijke dolfijnklikken in onderwateropnamen
- Beschermde wateren bevorderen de heropleving van de westkust-zeebaars
- Onderzoek naar maïsgenetica onthult het mechanisme achter het stil worden van eigenschappen
- Wat kan glycolyse stoppen?
- 'S Werelds botanische tuinen bevatten een derde van alle bekende plantensoorten, en help de meest bedreigde te beschermen
- Walvissen en dolfijnen hebben rijke mensachtige culturen en samenlevingen
- Het verzoenen van taxonveroudering met de Red Queens-hypothese
- Spray-on vloeibaar glas staat op het punt een revolutie teweeg te brengen in bijna alles
- Halfgeleider shish kabob nanostructuren combineren eigenschappen van verschillende dimensies
- Nieuwe elektronische stent kan feedback en therapie geven en vervolgens oplossen
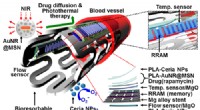
- Stralend licht op tweedimensionale magneten

- 'S Werelds kleinste spontane atoomvalentijn

 Metalen nanodeeltjes kunnen kankerbehandeling verbeteren
Metalen nanodeeltjes kunnen kankerbehandeling verbeteren Het gebruik van bossen om de CO2-uitstoot te compenseren vereist inzicht in de risico's
Het gebruik van bossen om de CO2-uitstoot te compenseren vereist inzicht in de risico's De uitzonderlijke oorsprong van EUV-licht in heet tinplasma
De uitzonderlijke oorsprong van EUV-licht in heet tinplasma Antibioticaresistentie bestrijden met fagen
Antibioticaresistentie bestrijden met fagen Wat betekent het klimaatbeleid van Trump voor de doelstellingen voor de reductie van broeikasgassen?
Wat betekent het klimaatbeleid van Trump voor de doelstellingen voor de reductie van broeikasgassen? Effecten van grondbewerking en bodembedekking op de graanproductie
Effecten van grondbewerking en bodembedekking op de graanproductie Nieuw onderzoek geeft nauwkeurig inzicht in ondergronds CO2-reductieproces
Nieuw onderzoek geeft nauwkeurig inzicht in ondergronds CO2-reductieproces Omkeerbare elektro-optische detector voor omgevingsdetectie van verontreinigende stoffen
Omkeerbare elektro-optische detector voor omgevingsdetectie van verontreinigende stoffen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

