
Wetenschap
Tumoren aanpakken met ijzeroxide
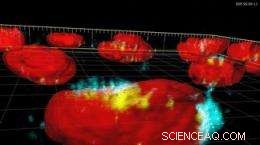
Foto:Superparamagnetische ijzeroxidedeeltjes (blauw en geel) geabsorbeerd in een celkern (kern in rood).
(PhysOrg.com) -- Kankercellen detecteren en vernietigen, het injecteren van medicijnen met extreme precisie in zieke cellen in het menselijk lichaam - dit zijn slechts twee voorbeelden van wat EPFL-wetenschappers proberen te bereiken met behulp van ijzeroxide-nanodeeltjes die zijn ontwikkeld in het School's Powder Technology Laboratory (LTP).
Slechts 5 – 10 nanometer in diameter (een nanometer is een miljoenste van een millimeter), de superparamagnetische ijzeroxide-nanodeeltjes die worden bestudeerd door het LTP-team van professor Heinrich Hofmann zijn veelbelovend, omdat ze magnetische eigenschappen vertonen wanneer ze worden blootgesteld aan een extern magnetisch veld. Die eigenschap is belangrijk voor bepaalde medische toepassingen, zoals het diagnosticeren van ziekten zoals artritis, tumoren lokaliseren, en het vernietigen van kankercellen bij patiënten.
Kanker opsporen
De EPFL-wetenschappers kijken naar drie hoofdtoepassingen:diagnostiek, behandeling en eliminatie van kwaadaardige cellen. “In de praktijk ijzeroxidedeeltjes worden al gebruikt als contrastmiddelen in Magnetic Resonance Imaging (MRI) in gevallen van levertumoren, ’ merkt Hofmann op. “We onderzoeken hoe we deze methode kunnen toepassen op allerlei tumoren en zo mogelijk ook op andere ziekten, zoals artritis. Dat laatste is het doel van een groot EU FP-7-project (Nanodiara).” Zo werkt het:kankercellen hebben receptoren op hun oppervlak, een soort mobiele ID. De omhulling van de nanodeeltjes wordt hierop aangepast (via antistoffen, bijvoorbeeld), zodat zodra ze intraveneus zijn geïnjecteerd, ze zullen zich alleen hechten aan de receptoren op de kankercellen. En omdat een ijzeroxidedeeltje het weefselcontrast verandert wanneer het wordt blootgesteld aan een magnetisch veld, het is dus mogelijk om de exacte locatie van kankercellen te bepalen met behulp van MRI. “Tot nu toe is deze techniek alleen gevalideerd voor levertumoren, want voor elk kankertype oppervlakte-elementen moeten worden toegevoegd, die het gedrag van de deeltjes veranderen. Toch is het vrij moeilijk om het gedrag van nanodeeltjes in een complexe vloeistof te begrijpen, zoals bloed, ’ legt hij uit.
Gerichte behandeling
Een aspect van het onderzoek richt zich op een opwindende nieuwe toepassing:gerichte medicijnafgifte aan specifieke cellen. "Het is mogelijk dat nanodeeltjes van ijzeroxide rechtstreeks in de organellen van een cel doordringen. Deze eigenschap opent de mogelijkheid om een medicijn rechtstreeks in het binnenste van een cel af te geven, ’, legt Hofmann uit. Dit heeft duidelijke voordelen ten opzichte van bestaande methoden voor medicijnafgifte. Universiteit van Genève radiologie professor Jean-Paul Vallée zegt:
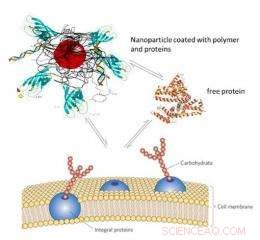
“In de huidige systemische medicamenteuze behandelingen, het medicijn wordt niet selectief in het lichaam afgeleverd, maar breed geabsorbeerd. Met deze nieuwe methode we zouden bepaalde bijwerkingen kunnen vermijden en het medicijn alleen kunnen afleveren aan de cellen die behandeld moeten worden.”
Tumoren vernietigen met hitte
Naast het detecteren van specifieke cellen en het rechtstreeks in hen afleveren van medicijnen, ijzeroxidedeeltjes hebben ook het vermogen om bottumoren hyperthermisch te vernietigen. Bij botkanker, uitzaaiingen ontstaan vaak in de wervelkolom. Een huidige behandeling omvat het injecteren van een cementachtige substantie in de lichamen van de wervels. Zodra deze op polymeer gebaseerde stof in het lichaam is, het stolt en stabiliseert zo de wervels. Volgens de onderzoekers is als superparamagnetische deeltjes vóór injectie aan het cement werden toegevoegd, het zou mogelijk zijn om energie over te dragen door een extern wisselend magnetisch veld aan te leggen, waardoor het implantaat wordt verwarmd tot 46°C. Deze procedure zou selectief kankercellen in de buurt vernietigen, omdat ze minder hittebestendig zijn dan normale weefsels. “Deze methode zou minder agressief zijn dan lasers, die ook gezonde cellen verbranden en afvalstoffen achterlaten, ”, vult Hofmann aan.
Op dit moment, deze drie toepassingen bevinden zich in de preklinische fase, en maken deel uit van verschillende projecten waarbij tal van partners betrokken zijn, zoals de Universitaire Ziekenhuizen van Lausanne (CHUV), de Universiteit van Genève en het Zwitserse Centrum voor Elektronica en Microtechnologie (CSEM), evenals bedrijven zoals ANTIA of MERCK-Serono.
 Sporenmateriaal vinden in afvalstoffen
Sporenmateriaal vinden in afvalstoffen Elektronendeficiëntie van fluorforen beïnvloedt de herkenningsprestaties van nabij-infrarood fluorescerende sondes
Elektronendeficiëntie van fluorforen beïnvloedt de herkenningsprestaties van nabij-infrarood fluorescerende sondes Adem in plaats van een bloedtest
Adem in plaats van een bloedtest Spanning en corrosie ontkoppelen om metaalfalen te voorspellen
Spanning en corrosie ontkoppelen om metaalfalen te voorspellen Biomimetische hydrogel met fotodynamisch antimicrobieel effect
Biomimetische hydrogel met fotodynamisch antimicrobieel effect
 Welke aanpassingen hebben vissen?
Welke aanpassingen hebben vissen?  Veel Afrikaanse landen overstromen, decennia van ontwikkeling riskeren als ze zich niet aanpassen
Veel Afrikaanse landen overstromen, decennia van ontwikkeling riskeren als ze zich niet aanpassen Activiteit met de Fibonacci-reeks
Activiteit met de Fibonacci-reeks Shakedown in Oklahoma:om het aantal grotere aardbevingen te verminderen, injecteer minder zout water
Shakedown in Oklahoma:om het aantal grotere aardbevingen te verminderen, injecteer minder zout water Studie evalueert emissies van Chinese binnenwateren in de afgelopen 30 jaar
Studie evalueert emissies van Chinese binnenwateren in de afgelopen 30 jaar
Hoofdlijnen
- Wat zijn de subeenheden van DNA?
- Kleine rode dieren schieten in het donker onder het ijs van een bevroren meer in Quebec
- Hoe kunnen kinderen van dezelfde ouders er zo verschillend uitzien?
- Het Bohr-model:snel vervangen maar nooit vergeten
- Wetenschappers werken samen aan onderzoek om bedreigde Afrikaanse pinguïns te redden
- Vrouwelijke wetenschappers die de wereld veranderden
- Wat is de schijfachtige structuur aan de zijde van chloroplasten?
- Wat is het verschil tussen Ribosoom en Ribosomaal DNA?
- Hoe zou zout Gist beïnvloeden?
- Bewijs van ingeklemde grafeenmembraan-superstructuur opent een membraanspecifieke medicijnafgiftemodus
- Nieuwe bio-geïnspireerde methode om hoogwaardig grafeen te kweken voor hoogwaardige elektronische apparaten

- Zelfgerolde buizen maken miniatuurelektronica

- Onderzoekers bouwen moleculaire nanovezels die sterker zijn dan staal

- Hoogtepunt:demping van akoestische trillingen in gouden nanodeeltjes

 Hogesnelheidsnetwerk voor eerstehulpverleners baart zorgen
Hogesnelheidsnetwerk voor eerstehulpverleners baart zorgen Minder vlees, meer bugs in onze voedingstoekomst, wetenschappers dringen nog steeds aan
Minder vlees, meer bugs in onze voedingstoekomst, wetenschappers dringen nog steeds aan Hoe zijn reptielen belangrijk voor de mens?
Hoe zijn reptielen belangrijk voor de mens?  Welke organel moet aanwezig zijn in grote aantallen in spiercellen?
Welke organel moet aanwezig zijn in grote aantallen in spiercellen?  Puntlassen grafeen nanoribbons atoom voor atoom
Puntlassen grafeen nanoribbons atoom voor atoom Model voorspelt de neiging van polymere voedselverpakkingen om aromamoleculen uit hun inhoud te absorberen
Model voorspelt de neiging van polymere voedselverpakkingen om aromamoleculen uit hun inhoud te absorberen Onderzoeker zet gedurfde stap door nanotech-recept vrij te geven
Onderzoeker zet gedurfde stap door nanotech-recept vrij te geven Twee- tot drievoudige toename van het optreden en de ernst van hittegolven, direct te zien in temperatuurrecords in het VK
Twee- tot drievoudige toename van het optreden en de ernst van hittegolven, direct te zien in temperatuurrecords in het VK
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

