
Wetenschap
Onderzoekers leveren bewijs bij mensen van RNA-interferentie met behulp van gerichte nanodeeltjes
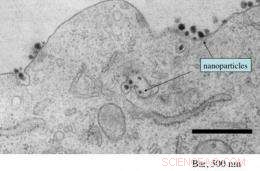
Deze elektronenmicrofoto toont de aanwezigheid van talrijke siRNA-bevattende gerichte nanodeeltjes die zowel een tumorcel binnenkomen als binnenin. Krediet:Caltech/Swaroop Mishra
Een team van onderzoekers en clinici onder leiding van het California Institute of Technology (Caltech) heeft het eerste bewijs gepubliceerd dat een gericht nanodeeltje - gebruikt als een experimenteel therapeutisch middel en rechtstreeks in de bloedbaan van een patiënt wordt geïnjecteerd - in tumoren kan terechtkomen, leveren dubbelstrengs kleine interfererende RNA's (siRNA's), en een belangrijk kankergen uitschakelen met behulp van een mechanisme dat bekend staat als RNA-interferentie (RNAi). Bovendien, leverde het team de eerste demonstratie dat dit nieuwe type therapie, doordrenkt met de bloedbaan, kan zijn weg vinden naar menselijke tumoren op een dosisafhankelijke manier - d.w.z. een hoger aantal nanodeeltjes dat het lichaam in wordt gestuurd, leidt tot een hoger aantal nanodeeltjes in de tumorcellen.
deze resultaten, gepubliceerd in de online-editie van het tijdschrift van 21 maart Natuur , de haalbaarheid aantonen van het gebruik van zowel nanodeeltjes als op RNAi gebaseerde therapieën bij patiënten, en de deur openen voor toekomstige "game-changing" therapieën die kanker en andere ziekten op genetisch niveau aanvallen, zegt Mark Davis, de Warren en Katharine Schlinger hoogleraar Chemical Engineering aan Caltech, en de leider van het onderzoeksteam.
De ontdekking van RNA-interferentie, het mechanisme waardoor dubbele strengen van RNA genen tot zwijgen brengen, wonnen onderzoekers Andrew Fire en Craig Mello in 2006 de Nobelprijs voor Fysiologie of Geneeskunde. De wetenschappers rapporteerden voor het eerst dat ze dit nieuwe mechanisme in wormen vonden in een 1998 Natuur papier. Vanaf dat moment, het potentieel voor dit type genremming om te leiden tot nieuwe therapieën voor ziekten zoals kanker is sterk aangeprezen.
"RNAi is een nieuwe manier om de productie van eiwitten te stoppen, ", zegt Davis. Wat maakt het zo'n potentieel krachtig hulpmiddel, hij voegt toe, is het feit dat het doelwit geen eiwit is. De kwetsbare delen van een eiwit kunnen verborgen zijn in zijn driedimensionale vouwen, waardoor het voor veel therapieën moeilijk is om ze te bereiken. In tegenstelling tot, RNA-interferentie richt zich op het boodschapper-RNA (mRNA) dat codeert voor de informatie die nodig is om in de eerste plaats een eiwit te maken.
"In principe, " zegt Davy, "dat betekent dat elk eiwit nu medicamenteus is omdat de remming ervan wordt bereikt door het mRNA te vernietigen. En we kunnen op een zeer ontworpen manier achter mRNA's aan gaan, gezien alle genomische gegevens die beschikbaar zijn en zullen komen."
Nog altijd, er zijn talrijke potentiële obstakels geweest voor de toepassing van RNAi-technologie als therapie bij mensen. Een van de meest problematische was het vinden van een manier om de therapieën te vervoeren, die zijn opgebouwd uit fragiele siRNA's, in tumorcellen na directe injectie in de bloedbaan. Davis, echter, oplossing gehad. Zelfs vóór de ontdekking van RNAi, hij en zijn team waren begonnen te werken aan manieren om nucleïnezuren via systemische toediening in cellen af te geven. Ze creëerden uiteindelijk een viercomponentensysteem - met een uniek polymeer - dat zichzelf kan assembleren tot een gerichte, siRNA-bevattend nanodeeltje. Het siRNA-afgiftesysteem wordt klinisch ontwikkeld door Calando Pharmaceuticals, Inc., een in Pasadena gevestigd nanobiotech-bedrijf.
"Deze nanodeeltjes zijn in staat om de siRNA's naar de beoogde plaats in het lichaam te brengen, ", zegt Davis. Zodra ze hun doel hebben bereikt, in dit geval, de kankercellen in tumoren - de nanodeeltjes komen de cellen binnen en geven de siRNA's vrij.
De wetenschappelijke resultaten beschreven in de Natuur papier zijn afkomstig uit een klinische fase I-studie van deze nanodeeltjes die in mei 2008 begon met de behandeling van patiënten. Fase I-studies zijn, per definitie, veiligheidsproeven; het idee is om te zien of en op welk niveau het medicijn of andere therapie schadelijk of toxisch wordt. Deze proeven kunnen ook een wetenschappelijk bewijs van concept bij de mens opleveren - en dat is precies wat wordt gerapporteerd in de Nature-paper.
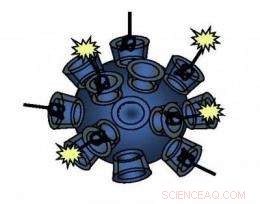
Dit gerichte nanodeeltje dat in het onderzoek is gebruikt en in dit schema wordt getoond, is gemaakt van een uniek polymeer en kan op een dosisafhankelijke manier zijn weg vinden naar menselijke tumorcellen. Krediet:Caltech/Derek Bartlett
Met behulp van een nieuwe techniek ontwikkeld bij Caltech, het team was in staat om nanodeeltjes te detecteren en in beeld te brengen in cellen die waren gebiopteerd uit de tumoren van verschillende deelnemers aan het onderzoek. In aanvulling, Davis en zijn collega's konden aantonen dat hoe hoger de dosis nanodeeltjes die aan de patiënt werd toegediend, hoe hoger het aantal deeltjes dat in de tumorcellen wordt gevonden - het eerste voorbeeld van dit soort dosisafhankelijke respons met behulp van gerichte nanodeeltjes.
Nog beter, Davis zegt, het bewijs toonde aan dat de siRNA's hun werk hadden gedaan. In de door de onderzoekers geanalyseerde tumorcellen, het mRNA dat codeert voor het celgroei-eiwit ribonucleotidereductase was afgebroken. Deze degradatie, beurtelings, leidde tot een verlies van het eiwit.
Beter gezegd, de gevonden mRNA-fragmenten hadden precies de lengte en sequentie die ze zouden moeten hebben als ze waren gesplitst op de plek die het doelwit was van het siRNA, merkt Davis op. "Het is de eerste keer dat iemand een RNA-fragment uit de cellen van een patiënt heeft gevonden waaruit blijkt dat het mRNA via het RNAi-mechanisme precies op de juiste basis is gesneden, " zegt hij. "Het bewijst dat het RNAi-mechanisme kan plaatsvinden met behulp van siRNA in een mens."
"Er zijn veel kankerdoelen die efficiënt kunnen worden geblokkeerd in het laboratorium met behulp van siRNA, maar ze in de kliniek blokkeren was ongrijpbaar, " zegt Antoni Ribas, universitair hoofddocent geneeskunde en chirurgie aan het Jonsson Comprehensive Cancer Center van de UCLA. "Dit komt omdat veel van deze doelwitten niet kunnen worden geblokkeerd door traditioneel ontworpen geneesmiddelen tegen kanker. Dit onderzoek levert het eerste bewijs dat wat in het laboratorium werkt, patiënten in de toekomst zou kunnen helpen door de specifieke afgifte van siRNA met behulp van gerichte nanodeeltjes. We kunnen gaan nadenken over het richten op het ontargetbare."
"Hoewel deze gegevens erg vroeg zijn en er meer onderzoek nodig is, dit is een veelbelovende studie van een nieuw kankerverwekkend middel, en we zijn trots op onze bijdrage aan de initiële klinische ontwikkeling van siRNA voor de behandeling van kanker, " zegt Anthony Tolcher, directeur klinisch onderzoek bij South Texas Accelerated Research Therapeutics (START).
"Veelbelovende gegevens uit de klinische onderzoeken valideren ons jarenlange onderzoek bij City of Hope naar ribonucleotidereductase als doelwit voor nieuwe op genen gebaseerde therapieën voor kanker, " voegt co-auteur Yun Yen toe, associate director voor translationeel onderzoek bij City of Hope. "We zien voor het eerst het nut van siRNA als kankertherapie en hoe nanotechnologie zich specifiek op kankercellen kan richten."
De Fase I-studie - gesponsord door Calando Pharmaceuticals - vindt plaats bij START en het Jonsson Comprehensive Cancer Center van de UCLA, en de klinische resultaten van de proef zullen op een later tijdstip worden gepresenteerd. "Op z'n minst, we hebben bewezen dat het RNAi-mechanisme bij mensen kan worden gebruikt voor therapie en dat de gerichte afgifte van siRNA systemische toediening mogelijk maakt, ', zegt Davis. 'Het is een heel spannende tijd.'
Hoofdlijnen
- Genomische studie onderzoekt de evolutie van zachte killer-bijen in Puerto Rico
- Hoe de gecorrigeerde WBC-telling te berekenen
- Hoe wordt glucose opgeslagen in plantencellen?
- Wat is de formule voor cellulaire ademhaling?
- Wat is het pad van het licht door het oog?
- Hoe moleculaire scharen ziekten kunnen oplossen en DNA kunnen bewerken
- Waarom hebben zoveel van onze huisdieren overgewicht?
- Wat doet een skelet bewegen?
Het skelet is het starre raamwerk dat een lichaam zijn algemene vorm geeft, maar op zichzelf is het niet in staat tot beweging. Wat een skelet doet bewegen is de samentrekking en ontspanning van spieren die ermee verbon
- Wetenschappers lokaliseren jaloezie in de monogame geest
- Onderzoekers onderzoeken de dynamiek van vloeibare metaaldeeltjes op nanoschaal

- Sandwichkatalysatoren bieden een hogere activiteit en duurzaamheid

- Israëls wetenschappers denken groots met de zeer, heel klein

- De willekeurige diffusie van ontbrekende atomen in grafeen observeren

- Gouden ontdekking van wetenschappers werpt licht op katalyse

 Nuttig of griezelig? Machines stellen Gmail-antwoorden voor
Nuttig of griezelig? Machines stellen Gmail-antwoorden voor India zegt dat Chinese constructie op rivier het water vervuilt
India zegt dat Chinese constructie op rivier het water vervuilt Het verschil tussen een ringvormige en een totale zonsverduistering
Het verschil tussen een ringvormige en een totale zonsverduistering  Tijdreizen is mogelijk – maar alleen als je een object met oneindige massa hebt
Tijdreizen is mogelijk – maar alleen als je een object met oneindige massa hebt Biocompatibel, antimicrobiële coating waarvan is aangetoond dat deze de groei van bacteriën beperkt
Biocompatibel, antimicrobiële coating waarvan is aangetoond dat deze de groei van bacteriën beperkt Onderzoeker dorst naar duurzame Everglades
Onderzoeker dorst naar duurzame Everglades Trump ontmoet chipmakers over Huawei, andere economische kwesties
Trump ontmoet chipmakers over Huawei, andere economische kwesties Ridesharing-links kunnen het gebruik van openbaar vervoer in de buitenwijken stimuleren
Ridesharing-links kunnen het gebruik van openbaar vervoer in de buitenwijken stimuleren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


