
Wetenschap
Wat is een voorbeeld de eerste wet van de thermodynamica?
scenario: Je kookt een pot water op het fornuis.
* Energie in: De kachel biedt warmte -energie aan de pot en het water.
* Energie uit: Het water absorbeert de warmte, waardoor de temperatuur stijgt. Sommige energie gaat ook verloren aan de omliggende lucht als warmte.
* Interne energie: De interne energie van het water neemt toe naarmate het heter wordt.
De eerste wet van de thermodynamica: Dit scenario toont aan dat de totale energie in het systeem constant blijft. De warmte -energie die door het fornuis wordt geleverd, wordt gebruikt om de interne energie van het water te vergroten (waardoor het heter wordt) en sommige zijn verloren in de omgeving.
Sleutelpunt: Energie kan niet worden gecreëerd of vernietigd, alleen van de ene vorm naar de andere worden getransformeerd.
Hier is hoe de eerste wet wiskundig wordt uitgedrukt:
* Δu =q + w
Waar:
* Δu is de verandering in interne energie van het systeem
* Q is de warmte toegevoegd aan het systeem
* W Wordt het werk gedaan door het systeem
In ons kookvoorbeeld:
* Δu is de toename van de interne energie van het water naarmate het heter wordt.
* Q is de warmte -energie die door het fornuis wordt geleverd.
* W is het werk dat door het water wordt gedaan (in dit voorbeeld te verwaarlozen, maar het kan werk zijn gedaan als het water uitbreidde en tegen iets duwde).
Laat het me weten als je meer voorbeelden of uitleg wilt!
 Evolutionaire oorsprong van dierlijke biodiversiteit
Evolutionaire oorsprong van dierlijke biodiversiteit Twee algemene type klimaat dat de productie van veldgewassen beïnvloedt?
Twee algemene type klimaat dat de productie van veldgewassen beïnvloedt?  Symbiotische relaties in koraalriffen
Symbiotische relaties in koraalriffen  India zou kunnen voldoen aan de luchtkwaliteitsnormen door het brandstofverbruik van huishoudens te verminderen
India zou kunnen voldoen aan de luchtkwaliteitsnormen door het brandstofverbruik van huishoudens te verminderen Epigenetica kan verklaren hoe Darwins vinken reageren op snelle veranderingen in het milieu
Epigenetica kan verklaren hoe Darwins vinken reageren op snelle veranderingen in het milieu
Hoofdlijnen
- Hoe lang duurt het om een gewoonte aan te leren? De driewekenregel
- Waarom is osmose belangrijk in uw lichaamscellen?
- Welke stap is niet bereikt door wetenschappers die de oorsprong van het leven bestuderen?
- Wat is een verschil tussen worm en virus?
- Waarom hebben verschillende eiwitten dezelfde relatieve moleculaire massa?
- Wat is de chemische structuur in menselijke genen?
- Klimaatverandering zal naar verwachting de capaciteit van kelpbossen om koolstof vast te houden en op te slaan verminderen
- Wie ontdekte cellen in het levende organisme?
- Tijdens glycolyse wordt ATP geproduceerd hoeveel netto moleculen worden gevormd?
- Het opvangen en beheersen van licht op het grensvlak van atomair dunne nanomaterialen
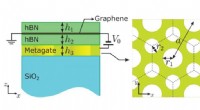
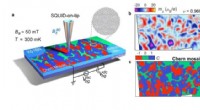
- De waarneming van Chern-mozaïek en Berry-curvature-magnetisme in magisch hoekgrafeen
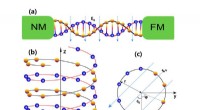
- Thermisch aangedreven spinstroom in DNA
- Nucleair — Niet van deze wereld

- Nieuwe methode voor het analyseren van netwerken onthult verborgen patronen in data

 Hoe omzetten procent in fractie
Hoe omzetten procent in fractie Onderzoekers bereiken de eerste condensatie van cesiumatomen die niet in de grondtoestand zitten
Onderzoekers bereiken de eerste condensatie van cesiumatomen die niet in de grondtoestand zitten  Waarom het mineraal van schelpdieren zich anders vormt in zeewater
Waarom het mineraal van schelpdieren zich anders vormt in zeewater  Waarom komt Andromeda naar ons toe?
Waarom komt Andromeda naar ons toe?  Gebruik van Noble Metals
Gebruik van Noble Metals Hoe worden de atomen genoemd, dan hebben ze hetzelfde atoomnummer maar verschillende massacijfers?
Hoe worden de atomen genoemd, dan hebben ze hetzelfde atoomnummer maar verschillende massacijfers?  Wat zijn voorbeelden voor mechanische warmte -energie?
Wat zijn voorbeelden voor mechanische warmte -energie?  The Goblin onthult mogelijk het spook van planeet X dat op de loer ligt in de verre ruimte
The Goblin onthult mogelijk het spook van planeet X dat op de loer ligt in de verre ruimte
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

