
Wetenschap
Wat is overlappende afstoting in de natuurkunde?
Hier is een uitsplitsing:
* elektronenwolken: Elektronen in atomen zijn niet vastgesteld op specifieke punten, maar bestaan in een ruimte met de ruimte die een elektronenwolk wordt genoemd.
* overlappen: Wanneer twee atomen te dichtbij komen, beginnen hun elektronenwolken elkaar te overlappen.
* Pauli -uitsluitingsprincipe: Dit overlapping dwingt elektronen met dezelfde draai om verschillende energieniveaus te bezetten, wat energie -input vereist. Deze energie -input manifesteert zich als een afstotende kracht.
* afstoting: De afstoting door de overlappende elektronenwolken voorkomt dat de atomen dichterbij komen en in elkaar versmelten.
Sleutelpunten:
* Overlapping afstoting is een korte-afstandskracht, wat betekent dat het alleen op zeer korte afstanden werkt.
* Het is verantwoordelijk voor de stabiliteit van materie, waardoor de ineenstorting van atomen en moleculen wordt voorkomen.
* Het is een kwantummechanisch effect, dat voortkomt uit de golfkarakter van elektronen.
Voorbeelden:
* vaste toestand: De rigide structuur van vaste stoffen is te wijten aan overlappende afstoting tussen de atomen.
* chemische binding: Overlapping afstoting speelt een cruciale rol bij chemische binding, het bepalen van de bindingslengte en stabiliteit van moleculen.
* botsingen: Overlapping afstoting is verantwoordelijk voor de elastische botsingen tussen atomen en moleculen.
Samenvattend: Overlappende afstoting is een fundamentele kracht in de fysica die voorkomt dat atomen in elkaar instorten, waardoor de stabiliteit van materie wordt gewaarborgd en de vorming van moleculen mogelijk maakt.
 Welke dingen hebben waterstof?
Welke dingen hebben waterstof?  Solvation-herschikking brengt stabiele zink/grafietbatterijen dichter bij commerciële netopslag
Solvation-herschikking brengt stabiele zink/grafietbatterijen dichter bij commerciële netopslag De molariteit van een oplossing 5,0 g KCl in 100 ml is?
De molariteit van een oplossing 5,0 g KCl in 100 ml is?  De eerste succesvolle vervangers voor ivoren biljartballen werden gemaakt met celluloid versterkt met gemalen runderbot
De eerste succesvolle vervangers voor ivoren biljartballen werden gemaakt met celluloid versterkt met gemalen runderbot  Welk product produceren waterstofperoxide water luminol ammoniumcarbonaat natriumkopersulfaat pentahydraat?
Welk product produceren waterstofperoxide water luminol ammoniumcarbonaat natriumkopersulfaat pentahydraat?
Hoofdlijnen
- De mysterieuze Denisovans
- Wat is de functie van chromosomen en centriolen?
- Hoe analyseren verschillende wetenschappers gegevens uit een experiment?
- In welke staat groeit Waratah op natuurlijke wijze?
- Waarom evolutie vaak de voorkeur geeft aan kleine dieren en andere organismen
- Hoe ontwikkelden bacteriën zich voor het eerst op aarde?
- In welke soorten cellen worden chloroplast gevonden?
- Welk percentage van een plantencel is water?
- 10 manieren waarop uw geheugen volledig onnauwkeurig is
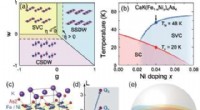
- Gepolariseerde neutronenverstrooiing onthult geprefereerde spin-excitaties in dubbellaagse op ijzer gebaseerde supergeleider
- Onderzoekers onderzoeken kenmerken van sterrenhopen rondom superzware zwarte gaten

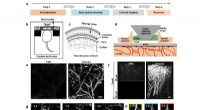
- Niet-invasief optisch opruimvenster van de schedel voor corticale beeldvorming
- Spinlasers vergemakkelijken een snelle gegevensoverdracht

- Gravitatiegolfdetectoren om naar donkere materie te zoeken

 Herbebossing van Amerikaanse bovengronden slaat enorme hoeveelheden koolstof op, met potentieel voor veel meer
Herbebossing van Amerikaanse bovengronden slaat enorme hoeveelheden koolstof op, met potentieel voor veel meer Vrienden tot het einde? Sociale signalen zorgen ervoor dat vissen de overlevingstactiek vertragen
Vrienden tot het einde? Sociale signalen zorgen ervoor dat vissen de overlevingstactiek vertragen  Wat is de betekenis van witte dwergsterren in het Hertzsprung-Russell-diagram?
Wat is de betekenis van witte dwergsterren in het Hertzsprung-Russell-diagram?  Wat is waar aan hoge wolken?
Wat is waar aan hoge wolken?  Wat kunnen sterren van een binair systeem doen?
Wat kunnen sterren van een binair systeem doen?  Leg uit hoe een hoofdreeksster als de zon stabiel kan blijven?
Leg uit hoe een hoofdreeksster als de zon stabiel kan blijven?  Over 30 jaar, het Antarctisch Verdrag kan worden gewijzigd, en het lot van een continent kan op het spel staan
Over 30 jaar, het Antarctisch Verdrag kan worden gewijzigd, en het lot van een continent kan op het spel staan Hoe werkt een weerballon?
Hoe werkt een weerballon?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

