
Wetenschap
Waarom moeten tariefwetten experimenteel worden bepaald?
* Reactiemechanisme: De snelheidswet weerspiegelt het mechanisme van de reactie, de reeks stappen die op moleculair niveau optreden. De evenwichtige vergelijking toont alleen de algehele stoichiometrie, niet de afzonderlijke stappen.
* Elementaire stappen: Rate-wetten worden bepaald door de langzaamste stap in het reactiemechanisme, bekend als de snelheidsbepalende stap. Deze stap kan verschillende reactanten of tussenproducten omvatten dan die getoond in de algehele evenwichtige vergelijking.
* moleculariteit: De exponenten van de snelheidswet (bestellingen van de reactie) komen overeen met de moleculariteit van de snelheidsbepalende stap. Dit betekent dat ze het aantal moleculen vertegenwoordigen dat betrokken is bij die specifieke stap, die kunnen verschillen van de stoichiometrische coëfficiënten in de gebalanceerde vergelijking.
Bijvoorbeeld:
Overweeg de reactie van waterstof en jodium om waterstofjodide te vormen:
H₂ (G) + I₂ (G) → 2Hi (G)
De evenwichtige vergelijking suggereert een enkele stapreactie, maar experimenteel blijkt de snelheidswet te zijn:
Tarief =k [h₂] [i₂]
Dit geeft aan dat de snelheidsbepalende stap de botsing van één waterstofmolecuul en één jodiummolecuul omvat, geen gelijktijdige reactie van meerdere moleculen zoals de gebalanceerde vergelijking zou kunnen impliceren.
Samenvattend:
Rate -wetten zijn gebaseerd op het reactiemechanisme, wat een complexe reeks stappen is. Dit mechanisme kan niet eenvoudig worden bepaald door naar de evenwichtige vergelijking te kijken. Daarom zijn experimenten nodig om de snelheidswet te bepalen en te begrijpen hoe de reactie op moleculair niveau verloopt.
 Welke invloed heeft de temperatuur op de titratie?
Welke invloed heeft de temperatuur op de titratie?  Strijd tegen antibioticaresistente bacteriën heeft een gloednieuw wapen
Strijd tegen antibioticaresistente bacteriën heeft een gloednieuw wapen Kunstmatige intelligentie zal de chemische ruimte in kaart brengen om te helpen navigeren door de grote diversiteit aan chemische verbindingen
Kunstmatige intelligentie zal de chemische ruimte in kaart brengen om te helpen navigeren door de grote diversiteit aan chemische verbindingen Wat zijn de drie stappen van een kettingreactie?
Wat zijn de drie stappen van een kettingreactie?  Is eierschaal een mengsel of een pure substantie?
Is eierschaal een mengsel of een pure substantie?
 Hoe P. juliflora-struikwortels arseen opruimen en immobiliseren uit giftige mijnresten
Hoe P. juliflora-struikwortels arseen opruimen en immobiliseren uit giftige mijnresten Hoe worden planten gegroeid in het licht anders dan het donker?
Hoe worden planten gegroeid in het licht anders dan het donker?  Opkomst van agressief rifroofdier kan herstel van zee-egels belemmeren, studie vondsten
Opkomst van agressief rifroofdier kan herstel van zee-egels belemmeren, studie vondsten Voorbij sociale netwerken:hoe culturele overtuigingen zich werkelijk verspreiden
Voorbij sociale netwerken:hoe culturele overtuigingen zich werkelijk verspreiden  Is de aarde overbevolkt?
Is de aarde overbevolkt?
Hoofdlijnen
- Waarom het bezitten van een agressieve hond isolerend kan zijn
- Umami-rijke schrootvissen en invasieve soorten kunnen groenten verlevendigen, zegt gastrofysicus
- Hebben slakken hun slijmsporen nodig om vooruit te komen? Het is een lastige vraag
- Het Tea Tree-genoom bevat aanwijzingen over hoe één blad zoveel smaken produceert
- Wat is de dubbele helix?
- Vertegenwoordigt interstitiële vloeistof één type extracellulair materiaal?
- Onderzoekers ontdekken hoe modelorganisme Tetrahymena roulette speelt met zeven geslachten
- Kunnen ziektedetecterende honden de dikhoornschapen in South Dakota helpen redden?
- Welke functionele groep hoort melkzuur?
- Kijken naar de kristalstructuur van lithium

- Eschers engelen en demonen houtsnede voorspelt hoe materie vervormt

- Random access memory op een energiezuinig dieet:onderzoekers ontwikkelen basis voor een nieuwe geheugenchip

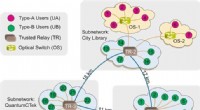
- Implementatie van een 46-node quantum metropolitan area network
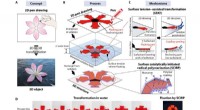
- Directe 2D-naar-3D-transformatie van pentekeningen
 Als er een boom in het bos valt en niemand het kan horen, verandert er dan klimaatverandering?
Als er een boom in het bos valt en niemand het kan horen, verandert er dan klimaatverandering?  Geschokt gas bij botsingen met sterrenstelsels
Geschokt gas bij botsingen met sterrenstelsels Studie reconstrueert oude stormen om veranderingen in tropische cycloonhotspot te helpen voorspellen
Studie reconstrueert oude stormen om veranderingen in tropische cycloonhotspot te helpen voorspellen Wat is het oudste celtype?
Wat is het oudste celtype?  Wat zijn cellen die geen afzonderlijke kern hebben genoemd?
Wat zijn cellen die geen afzonderlijke kern hebben genoemd?  Wat zijn biologische buffers?
Wat zijn biologische buffers?  Gap-geometrie begrepen:nieuw algoritme kan helpen de structuur van vloeistoffen te begrijpen, en hoe ze door poreuze media stromen
Gap-geometrie begrepen:nieuw algoritme kan helpen de structuur van vloeistoffen te begrijpen, en hoe ze door poreuze media stromen  Levenscyclus van Pythium
Levenscyclus van Pythium
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

