
Wetenschap
Hoe heeft Dmitri Menedeleyev elementen op zijn eerste periodieke tabel geregeld?
Hier is een uitsplitsing:
1. toenemende atoommassa: Hij vermeldde elementen in volgorde van toenemende atoommassa, te beginnen met het lichtste element, waterstof. Dit was het primaire organisatieprincipe.
2. Vergelijkbare chemische eigenschappen: Hij merkte terugkerende patronen op in de chemische eigenschappen van elementen. Elementen met vergelijkbare eigenschappen verschenen regelmatig in zijn tabel.
3. Perioden en groepen: Mendeleev regelde elementen in rijen genaamd perioden en kolommen genaamd groepen . Elementen in dezelfde groep deelden vergelijkbare chemische eigenschappen.
Het is belangrijk op te merken dat het periodieke tafel van Mendeleev niet perfect was. Het had op dat moment enkele onnauwkeurigheden vanwege het beperkte begrip van de atoomstructuur. Hij plaatste bijvoorbeeld Tellurium (TE) vóór jodium (I), hoewel jodium een iets lagere atoommassa heeft. Dit kwam omdat hij erkende dat jodium beter paste in groep VII met de andere halogenen op basis van zijn chemische eigenschappen.
Belangrijke kenmerken van het periodieke tabel van Mendeleev:
* voorspellende kracht: Mendeleev liet gaten in zijn tafel achter voor elementen die nog moesten worden ontdekt. Hij gebruikte de periodieke trends om de eigenschappen van deze onontdekte elementen te voorspellen.
* Basis voor moderne periodieke tabel: De tabel van Mendeleev legde de basis voor het moderne periodieke tabel, dat is gebaseerd op atoomnummer in plaats van op atomaire massa.
Zijn innovatieve werk bracht een revolutie teweeg in het begrip van chemische elementen en hun relaties, waardoor een kader voor toekomstige ontdekkingen in de chemie was.
 Synthetisch slijm kan het echte werk nabootsen
Synthetisch slijm kan het echte werk nabootsen Wat is de kleur vorm hardheid chemische samenstelling diagnostische eigenschap streep glans breuk gebruik van mineralen?
Wat is de kleur vorm hardheid chemische samenstelling diagnostische eigenschap streep glans breuk gebruik van mineralen?  Hoe een citroenzuurbufferoplossing te maken
Hoe een citroenzuurbufferoplossing te maken Wordt Cl2 bij elkaar gehouden door ionische binding?
Wordt Cl2 bij elkaar gehouden door ionische binding?  Onderzoekers ontwerpen sensoren om plantenhormonen snel te detecteren
Onderzoekers ontwerpen sensoren om plantenhormonen snel te detecteren
 Fluisterende dennen:Bomen vertellen het verhaal van het slagschip uit de Tweede Wereldoorlog
Fluisterende dennen:Bomen vertellen het verhaal van het slagschip uit de Tweede Wereldoorlog Sonaronderzoek toont krater gemaakt door A-bomtest op het Bikini-atol onder water
Sonaronderzoek toont krater gemaakt door A-bomtest op het Bikini-atol onder water Is Lichen een Autotroph?
Is Lichen een Autotroph?  Afvalwateroplossingen gericht op landbouw in Ghana
Afvalwateroplossingen gericht op landbouw in Ghana Seismische activiteit van de alpiene breuk in Nieuw-Zeeland complexer dan vermoed
Seismische activiteit van de alpiene breuk in Nieuw-Zeeland complexer dan vermoed
Hoofdlijnen
- Hoe kabbelende tongen van honden kolommen met vloeistof creëren, waardoor ze water kunnen opslokken
- Het onzichtbare zien:hoe vlinders wetenschappers kunnen helpen kanker op te sporen
- Het verschil tussen een sporofyt en gametofyt
- Fermentatie treedt op wanneer een cel wordt?
- Wat zijn de 3 takken van wetenschap en subtakken?
- Hoe damselfish en myside garnalen naast elkaar bestaan in een wederzijds voordelige relatie
- Hoe menselijke migratie werkt
- Kenia mannelijke leeuwen gezien in intieme daad; binding, deskundigen zeggen
- Wat breekt een dubbele DNA-helix uiteen?
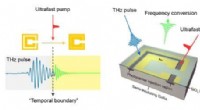
- Kleur van licht veranderen met behulp van een tijdruimtelijke grens
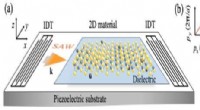
- Onconventionele fenomenen veroorzaakt door akoestische golven in 2D-materialen
- Natuurkundigen stellen nieuwe manier voor om fusieplasma's van de volgende generatie te stabiliseren

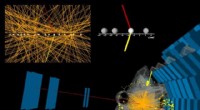
- ATLAS-experiment rapporteert de waarneming van fotonbotsingen die dragers met zwakke kracht produceren
- Willekeurige effecten sleutel tot het indammen van epidemieën

 Grizzlies vertonen opmerkelijke gencontrole vóór en tijdens de winterslaap
Grizzlies vertonen opmerkelijke gencontrole vóór en tijdens de winterslaap  Nieuw ontwerp voor nanodeeltjes die energiezuinig licht absorberen, hoogenergetisch licht uitzenden, kan worden gebruikt in biologische beeldvorming
Nieuw ontwerp voor nanodeeltjes die energiezuinig licht absorberen, hoogenergetisch licht uitzenden, kan worden gebruikt in biologische beeldvorming AI-aangedreven schoenen ontsluiten de geheimen van je zool
AI-aangedreven schoenen ontsluiten de geheimen van je zool Hoe bereken je mol atomen in 9,00 g magnesiumnitraat?
Hoe bereken je mol atomen in 9,00 g magnesiumnitraat?  Welke chemicaliën en moleculen zijn nodig voor PCR Wat is de functie van elke component?
Welke chemicaliën en moleculen zijn nodig voor PCR Wat is de functie van elke component?  Onderzoek laat zien hoe tanden functioneerden en evolueerden bij gigantische megahaaien
Onderzoek laat zien hoe tanden functioneerden en evolueerden bij gigantische megahaaien  Hoe maak je een 3D-kaart van het heelal - en waarom?
Hoe maak je een 3D-kaart van het heelal - en waarom? Op zoek naar een hydrofiele nanodeeltjesoplossing voor antibioticaresistentie
Op zoek naar een hydrofiele nanodeeltjesoplossing voor antibioticaresistentie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

