
Wetenschap
Hoe zou u de atoommassa van het atoom berekenen zonder periodieke tabel te gebruiken als het aantal neutronen en neutronen weet nummerprotonen?
Inzicht in atomaire massa
* protonen en neutronen: Deze deeltjes vormen de kern van een atoom en dragen aanzienlijk bij aan de massa ervan.
* elektronen: Elektronen hebben een verwaarloosbare massa in vergelijking met protonen en neutronen, dus ze zijn meestal niet opgenomen in de berekening van de atoommassa.
Berekening
1. Identificeer het aantal protonen (atoomnummer): Het aantal protonen definieert het element.
2. Identificeer het aantal neutronen: Dit wordt vaak in het probleem gegeven of u kunt het berekenen door het atoomnummer af te trekken van het massanummer.
3. Voeg het aantal protonen en neutronen toe: Deze som geeft je de atoommassa van het atoom.
Voorbeeld:
Laten we zeggen dat je een atoom hebt met:
* 6 protonen
* 6 neutronen
* 6 elektronen
1. Atoomnummer: 6 (aantal protonen)
2. Atomische massa: 6 (protonen) + 6 (neutronen) =12
belangrijke opmerkingen:
* Atomic Mass Unit (AMU): De atomaire massa wordt uitgedrukt in atomaire massa -eenheden (AMU). Eén AMU is ongeveer gelijk aan de massa van een proton of neutron.
* isotopen: Atomen van hetzelfde element kunnen verschillende aantallen neutronen hebben, wat leidt tot isotopen. De atoommassa die u berekent, vertegenwoordigt de massa van een specifieke isotoop.
* Gemiddelde atoommassa: Het periodiek systeem toont de gemiddelde atoommassa voor elk element, rekening houdend met de natuurlijke overvloed van verschillende isotopen.
Laat het me weten als je met een ander voorbeeld wilt oefenen!
 Water vormt ruggengraat van hydratatie rond DNA, groepsvondsten
Water vormt ruggengraat van hydratatie rond DNA, groepsvondsten Waarom heeft fluor een kleinere atoomstraal dan zowel zuurstof als chloor?
Waarom heeft fluor een kleinere atoomstraal dan zowel zuurstof als chloor?  Industrieel gebruik van jodium
Industrieel gebruik van jodium  De oorzaak van capaciteitsverlies vinden in een metaaloxide batterijmateriaal
De oorzaak van capaciteitsverlies vinden in een metaaloxide batterijmateriaal Als een verbinding een empirische formule van CH en een massa van 26 gram heeft, wat is dan de molecuulformule?
Als een verbinding een empirische formule van CH en een massa van 26 gram heeft, wat is dan de molecuulformule?
Hoofdlijnen
- Welk van de drie regio's bevat het oss van de regio's?
- Mannelijke spinnen laten zich van hun gevoelige kant zien
- Waarom bereiken de meeste organismen zelden hun biotische potentieel?
- Een populatiebrede gen-omgevingsinteractiestudie naar hoe genen, scholen en woonwijken prestaties vormgeven
- De ontdekking van hoe de niche van stamcellen differentiatie naar functionele cellen begeleidt, is een belangrijke stap in de richting van therapieën
- Biomarkers die worden gebruikt om de voordelen van anti-verouderingstherapieën bij te houden, kunnen misleidend zijn, suggereert de Lifespan Machine
- Studie werpt licht op hoe cellen materialen transporteren langs drukke intercellulaire 'snelwegen'
- Hoe de hormonen van de hypofyse te onthouden
- Goede hond of slechte hond? Nieuwe studie toont aan dat ras niet echt een voorspeller is van gedrag
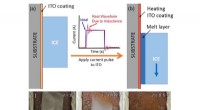
- Ontdooien van oppervlakken in seconden
- Het tellen van fotonen is nu routine genoeg om standaarden nodig te hebben

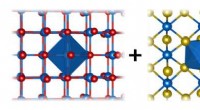
- Wetenschappers vangen licht in een polymeer quasikristal

- Wetenschappers vinden een nieuwe manier om nieuwe materialen te maken door niet te knijpen
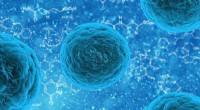
- Onderzoek onthult hoe wonden in golven genezen
 De nieuwe toestemmingscampagne in Australië heeft veel gelijk:maar toestemmingseducatie zal niet voldoende zijn om seksueel geweld te stoppen
De nieuwe toestemmingscampagne in Australië heeft veel gelijk:maar toestemmingseducatie zal niet voldoende zijn om seksueel geweld te stoppen  Welk domein bevat organismen met een kern in hun cellen?
Welk domein bevat organismen met een kern in hun cellen?  Voor de reactie is Cl2 plus 2 KBr gelijk aan Br2. Bereken het opbrengstpercentage als 200 g reageert met overmaat KBr om 410 Br2 te produceren?
Voor de reactie is Cl2 plus 2 KBr gelijk aan Br2. Bereken het opbrengstpercentage als 200 g reageert met overmaat KBr om 410 Br2 te produceren?  Elon Musks SpaceX gaat $ 500 miljoen ophalen:rapport
Elon Musks SpaceX gaat $ 500 miljoen ophalen:rapport Nieuwe afbeeldingen van asteroïden laten een veel grotere impact zien dan verwacht
Nieuwe afbeeldingen van asteroïden laten een veel grotere impact zien dan verwacht Onderzoek toont aan hoe algen kunnen omgaan met veranderingen in het milieu
Onderzoek toont aan hoe algen kunnen omgaan met veranderingen in het milieu  Studie over Syrische oorlog levert nieuw voorspellend model op voor uitputtingsdynamiek in multilaterale oorlog
Studie over Syrische oorlog levert nieuw voorspellend model op voor uitputtingsdynamiek in multilaterale oorlog De virale parasieten van gigantische virussen in de loop van de tijd volgen
De virale parasieten van gigantische virussen in de loop van de tijd volgen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

