
Wetenschap
Wat is de sterkste kracht tussen de deeltjes in een monster SO2?
Zwaveldioxide (SO2) is een polair molecuul, wat betekent dat het een positief uiteinde en een negatief uiteinde heeft. Het positieve uiteinde van het molecuul is het zwavelatoom en het negatieve uiteinde is het zuurstofatoom. Het verschil in elektronegativiteit tussen zwavel- en zuurstofatomen zorgt voor een gedeeltelijke positieve lading op het zwavelatoom en een gedeeltelijke negatieve lading op het zuurstofatoom. Deze gedeeltelijke ladingen zorgen ervoor dat SO2-moleculen elkaar kunnen aantrekken via dipool-dipoolkrachten.
Dipool-dipoolkrachten zijn intermoleculaire krachten die optreden tussen polaire moleculen. Ze worden veroorzaakt door de aantrekkingskracht tussen het positieve uiteinde van het ene molecuul en het negatieve uiteinde van een ander molecuul. Dipool-dipoolkrachten zijn zwakker dan waterstofbruggen en ionische bindingen, maar sterker dan van der Waals-krachten.
 Ecosysteemherstel is een urgent probleem in gefragmenteerd regenwoud
Ecosysteemherstel is een urgent probleem in gefragmenteerd regenwoud Onderzoek onderzoekt voor het eerst de voordelen en kosten van nieuwe waterhergebruiksystemen
Onderzoek onderzoekt voor het eerst de voordelen en kosten van nieuwe waterhergebruiksystemen Hoe het nieuwe mensenrecht op een gezond milieu de actie van Nieuw-Zeeland op het gebied van klimaatverandering kan versnellen
Hoe het nieuwe mensenrecht op een gezond milieu de actie van Nieuw-Zeeland op het gebied van klimaatverandering kan versnellen Hoe droogte de maïsopbrengsten beïnvloedt
Hoe droogte de maïsopbrengsten beïnvloedt  Miami Beachs laatste straatgevecht:wie wordt overspoeld door het overstromingswater?
Miami Beachs laatste straatgevecht:wie wordt overspoeld door het overstromingswater?
Hoofdlijnen
- VS zegt dat sneeuwminnende lynx geen speciale bescherming meer nodig heeft
- Wat is het effect van prokaryote indringers?
- Een nieuwe ontdekking toont aan dat grote bloeiende planten 150 miljoen jaar ouder zijn dan eerder werd gedacht
- Nieuwe studie vergroot het begrip van hoe antibioticaresistentie ontstaat
- Welke afkortingen voor enzymen die betrokken zijn bij de afbraak van glucose?
- Hoe het toevoegen van groene thee-extract aan bereid voedsel het risico op norovirus kan verminderen
- Planten kunnen zichzelf verdedigen door rupsen kannibaal te maken
- Hoe gist reageert op verandering:Ontwikkeling van een nieuw protocol maakt het mogelijk om complete set eiwitniveaus te meten
- Verschil tussen transcriptie en DNA-replicatie
- Modulaire blauwe lichtgevoelige fotoschakelaar ontwikkeld voor optogenetische engineering
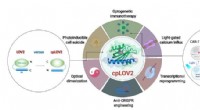
- Robots leren sneller met kwantumtechnologie

- Een twist die magnetisme en elektronische bandtopologie verbindt
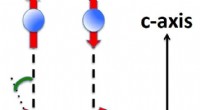
- Onderzoek naar het samenspel van topologie en niet-Hermitische fysica met niet-lineaire effecten

- Exotische eigenschap van tweehandige kristallen wijst op nieuwe magnetische verschijnselen
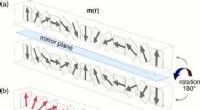
 Onderzoeksteam onderzoekt model om ruis in foto's te corrigeren
Onderzoeksteam onderzoekt model om ruis in foto's te corrigeren Terugroepacties voor voertuigveiligheid:waarom chauffeurs er geen acht op slaan
Terugroepacties voor voertuigveiligheid:waarom chauffeurs er geen acht op slaan  Wat zijn de verschillen tussen subscripts en coëfficiënten?
Wat zijn de verschillen tussen subscripts en coëfficiënten?  Exotische nieuwe topologische toestand ontdekt in Dirac-halfmetalen
Exotische nieuwe topologische toestand ontdekt in Dirac-halfmetalen Supercharged onweersbuien:hebben we onderschat hoe klimaatverandering extreme regen en overstromingen veroorzaakt?
Supercharged onweersbuien:hebben we onderschat hoe klimaatverandering extreme regen en overstromingen veroorzaakt?  Wat is 'gegarandeerd inkomen'?
Wat is 'gegarandeerd inkomen'?  Fluviatiele kartering van Mars
Fluviatiele kartering van Mars Een minuut gelijktijdige analyse van scherpte componenten in Kimchi
Een minuut gelijktijdige analyse van scherpte componenten in Kimchi
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

