
Wetenschap
Wat is de relatieve sterkte van dipool-dipoolkrachten?
De sterkte van dipool-dipoolkrachten kan worden geschat met behulp van de volgende vergelijking:
$$E_\text{dipool-dipool} =-\frac{\mu_1 \mu_2}{4\pi\varepsilon_0 r^3}$$
waar:
* \(E_\text{dipool-dipool}\) is de dipool-dipool-interactie-energie in joules (J)
* \(\mu_1\) en \(\mu_2\) zijn de grootheden van de permanente dipolen van de twee moleculen in debyes (D)
* \(\varepsilon_0\) is de permittiviteit van de vrije ruimte, die gelijk is aan 8,85 × 10-12 C^2/(N·m²)
* \(r\) is de afstand tussen de middelpunten van de twee moleculen in meters (m)
Het negatieve teken in de vergelijking geeft aan dat dipool-dipoolkrachten aantrekkelijke krachten zijn.
De sterkte van dipool-dipoolkrachten neemt snel af met toenemende afstand tussen de moleculen. Dit komt omdat het elektrische veld van een dipool snel afneemt met de afstand. De sterkte van de dipool-dipoolkrachten neemt ook af bij toenemende temperatuur. Dit komt omdat de thermische beweging van de moleculen ervoor zorgt dat de dipolen fluctueren, waardoor de gemiddelde sterkte van de dipool-dipoolinteracties afneemt.
Dipool-dipoolkrachten zijn belangrijk bij het begrijpen van de eigenschappen van veel stoffen, zoals de kookpunten en smeltpunten van vloeistoffen, en de oplosbaarheid van gassen in vloeistoffen.
 Landforms veroorzaakt door Plate Tectonics
Landforms veroorzaakt door Plate Tectonics  Het succes van de vermindering van luchtverontreinigende stoffen in China kan het moeilijker maken om de klimaatverandering te beheersen
Het succes van de vermindering van luchtverontreinigende stoffen in China kan het moeilijker maken om de klimaatverandering te beheersen De ademende Himalaya:Grote bergen groeien in een cyclus van stijgen en dalen
De ademende Himalaya:Grote bergen groeien in een cyclus van stijgen en dalen Welk object kan jou beschrijven?
Welk object kan jou beschrijven?  Ze hebben het bos voor altijd beheerd. Daarom zijn ze van cruciaal belang in de strijd tegen de klimaatverandering
Ze hebben het bos voor altijd beheerd. Daarom zijn ze van cruciaal belang in de strijd tegen de klimaatverandering
Hoofdlijnen
- Lijst met celorganellen en hun functies
- Genetische veerkracht en aanpassing van de met uitsterven bedreigde Chinese hazelnoot
- Team ontdekt hoe een eiwit zijn weg vindt
- Voorbeelden van hittebestendige bacteriën
- Zullen tropische bergboomsoorten zich aanpassen aan de opwarming?
- In het laboratorium gekweekt vlees zou de mensheid een ernstig moreel falen kunnen laten negeren
- Hoe vetcellen werken
- Hoe internationaal toerisme en reizen een manier kunnen zijn om invasieve soorten te introduceren
- Hoe is marshmallow gerelateerd aan colloïdale systemen?
- Terahertz-beeldvormingstechniek onthult ondergrondse insectenschade in hout

- Herinneringen en energielandschappen van magnetische glazige toestanden
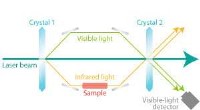
- Met een kwantumeffect kunnen infraroodmetingen worden uitgevoerd door zichtbaar licht te detecteren
- Onderzoekers leggen bewegende objecten vast met ghost imaging
- Neutrino-faciliteit kan het begrip van het universum veranderen

 Gerichte coating verbetert grafeenoxidemembranen voor nanofiltratie
Gerichte coating verbetert grafeenoxidemembranen voor nanofiltratie Hoe we onze planeet koel kunnen houden, zelfs als het gebruik van airconditioning stijgt
Hoe we onze planeet koel kunnen houden, zelfs als het gebruik van airconditioning stijgt Europees parlement roept klimaatnoodtoestand uit
Europees parlement roept klimaatnoodtoestand uit De Hope-sonde van de VAE komt als eerste in een baan om Mars voor de Arabische wereld
De Hope-sonde van de VAE komt als eerste in een baan om Mars voor de Arabische wereld Blanke Amerikanen besteden minder aandacht aan zwarte leeftijdsgenoten, zegt een nieuwe studie
Blanke Amerikanen besteden minder aandacht aan zwarte leeftijdsgenoten, zegt een nieuwe studie Wetenschappers maken één apparaat dat geschikt is voor dubbele transistorwerking
Wetenschappers maken één apparaat dat geschikt is voor dubbele transistorwerking 3D holografische head-up display kan de verkeersveiligheid verbeteren
3D holografische head-up display kan de verkeersveiligheid verbeteren Verrassende inzichten over puinstromen op Mars
Verrassende inzichten over puinstromen op Mars
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

