
Wetenschap
Het doorbreken van de lokale symmetrie – waarom water bevriest maar silica een glas vormt
Silica daarentegen is een covalente netwerkvaste stof. Dit betekent dat de siliciumatomen in silica covalent aan elkaar gebonden zijn, waardoor een sterke, stijve structuur ontstaat. Er zijn geen zwakke intermoleculaire krachten tussen silicamoleculen, dus silica vormt geen kristallijne structuur als het afkoelt. In plaats daarvan vormt het een glas, een niet-kristallijne vaste stof.
Het verschil in de manier waarop water en silica bevriezen is te wijten aan de verschillende soorten intermoleculaire krachten die in elk materiaal aanwezig zijn. De sterke waterstofbruggen tussen watermoleculen zorgen ervoor dat water een kristallijne structuur kan vormen, terwijl het ontbreken van sterke intermoleculaire krachten tussen silicamoleculen verhindert dat silica een kristallijne structuur vormt.
 Zullen cyborgs gemaakt worden van melanine? Pigmentdoorbraak maakt biocompatibele elektronica mogelijk
Zullen cyborgs gemaakt worden van melanine? Pigmentdoorbraak maakt biocompatibele elektronica mogelijk Het bestuderen van virale uitbraken in afzonderlijke cellen zou nieuwe manieren kunnen onthullen om ze te verslaan
Het bestuderen van virale uitbraken in afzonderlijke cellen zou nieuwe manieren kunnen onthullen om ze te verslaan Zelfherstellend materiaal kan zichzelf opbouwen uit koolstof in de lucht
Zelfherstellend materiaal kan zichzelf opbouwen uit koolstof in de lucht Hoe wordt cafeïnevrije koffie gemaakt? En het is echt cafeïnevrij?
Hoe wordt cafeïnevrije koffie gemaakt? En het is echt cafeïnevrij?  Voorkom voedselbesmetting met een duurzame coating voor harde oppervlakken
Voorkom voedselbesmetting met een duurzame coating voor harde oppervlakken
Hoofdlijnen
- Wat is het verschil tussen een mens en een fruitvlieg?
- Hoe groot is de kans dat Engelse leerlingen de middelbare school voltooien? Uit onderzoek blijkt dat dit afhangt van ras, geslacht en inkomen
- UV-licht: positieve en negatieve effecten
- Waarom verplaatsen chloroplasten zich in Elodea?
- Hoe erfelijke ziekten werken
- UW-wetenschappers ontrafelen het mysterie van hoe griepvirussen zich vermenigvuldigen
- PARP-1 regels! Wetenschappers ontdekken hoe een eiwit zich aan genen bindt en het menselijk genoom reguleert
- Het team van Rensselaer laat zien hoe je ruwe overheidsdata analyseert
- Nieuwe suikerglasfilm gebruikt virussen om schadelijke bacteriën in voedsel te doden
- Nieuw optisch apparaat op waterbasis zorgt voor een revolutie op het gebied van optisch onderzoek
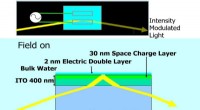
- Waterige verandering bij lage temperatuur van zirkoon van Mars tijdens de late Amazone-periode

- Onderzoekers ontwerpen compacte krachtige laser met behulp van plasma-optica

- Onderzoekers testen de manier waarop we krachten in het universum begrijpen

- Een samenwerking tussen kunst en wetenschap verkent de turbulente fysica van draaikolken

 Magnesiumdiboride wordt supergeleidend bij een hogere temperatuur wanneer het wordt uitgerekt
Magnesiumdiboride wordt supergeleidend bij een hogere temperatuur wanneer het wordt uitgerekt Vervangen robots menselijke soldaten?
Vervangen robots menselijke soldaten?  Onder druk van China, Apple trekt protest-app Hong Kong in
Onder druk van China, Apple trekt protest-app Hong Kong in Europese grensoverschrijdende bus- en treinreizen eenvoudig gemaakt
Europese grensoverschrijdende bus- en treinreizen eenvoudig gemaakt Een beeld zegt meer dan 1000 woorden, maar hoeveel emoties?
Een beeld zegt meer dan 1000 woorden, maar hoeveel emoties?  Wil je weten wat oude koala's aten? Controleer de tanden van moderne koala's
Wil je weten wat oude koala's aten? Controleer de tanden van moderne koala's  Verbeterde 3D-beeldvorming klaar om behandelingen voor hersenziekten te bevorderen
Verbeterde 3D-beeldvorming klaar om behandelingen voor hersenziekten te bevorderen Om netto nulemissie te bereiken, het VK moet verder gaan dan het uitschakelen van de koolstofkranen
Om netto nulemissie te bereiken, het VK moet verder gaan dan het uitschakelen van de koolstofkranen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

