
Wetenschap
Het knelpunt:waarom natuurkundigen nog steeds moeite hebben om het vermogen van ijs om zich te hechten en glad te worden te begrijpen
Of het nu in de vorm van rijp is of in de vorm van een glad, transparant ijsblokje, ijs hecht zich spontaan en zelfs behoorlijk sterk aan veel vaste oppervlakken. Maar zoals elke onvoorzichtige persoon die op een winters trottoir is uitgegleden kan getuigen, kan ijs ook erg glad zijn. In feite kan ijs zowel plakkerig zijn als en glad.
Deze veelzijdigheid heeft wetenschappers lange tijd in verwarring gebracht. Om te beginnen proberen ze al meer dan 150 jaar het geheim achter de gladheid van het ijs te ontrafelen. Onder hen waren beroemde natuurkundigen zoals Lord Kelvin en Michael Faraday. Deze laatste, beter bekend om zijn werk op het gebied van elektromagnetisme, was de eerste die de aanwezigheid voorzag van een dunne laag vloeibaar water die ijs bedekt, zelfs ver onder de 0°C. Destijds redeneerde hij dat het contact van een vast voorwerp met de oppervlaktelaag ervoor zorgde dat het als smeermiddel ging werken, waardoor de wrijving op het ijs aanzienlijk werd verminderd. Het bestaan van deze vloeistoflaag werd ruim een eeuw later door experimenten bevestigd.
Een gladde materie
Om de vraag te beantwoorden:"Waarom is ijs glad?" we moeten eerst begrijpen hoe deze dunne laag vloeibaar water op het bevroren oppervlak tot stand is gekomen.
Omdat water in vloeibare fase een grotere dichtheid heeft dan in ijzige toestand, werd lang gedacht dat het smelten van het ijsoppervlak verband hield met overmatige druk, bijvoorbeeld als gevolg van het gewicht van de schaatser op het kleine oppervlak dat eronder lag. zijn schaatsen. Door het ijs verder samen te drukken, zou de schaatser het laten smelten, waardoor het vloeibaar en glad zou worden.
Anderen geloven dat er warmte vrijkomt door wrijving als het voorwerp over het ijs beweegt, waardoor het oppervlak smelt. Net zoals wanneer je je handen tegen elkaar wrijft om ze op te warmen, worden ze warm als je de ene vaste stof tegen de andere wrijft.
Deze twee mechanismen verklaren echter niet waarom ijs onder de -20°C glad blijft. Bij zulke temperaturen zou er een aanzienlijke druk nodig zijn (ongeveer 500 maal die van een schaats) om deze te laten smelten.
In de jaren zestig, ruim een eeuw na Faraday, schreef J.W. Telford en J.S. Turner trok langzaam een draad door "koud" ijs (onder -20°C) en onthulde dat het tot -35°C glad bleef. Op dat moment was de hitte die vrijkwam door wrijving niet langer voldoende om het ijs te smelten.
Pas ongeveer een eeuw na de intuïtie van Faraday konden we deze vloeistoflaag indirect aantonen, door de eigenschappen van het ijsoppervlak te meten en niet het volume – in dit geval de eigenschappen van de absorptie van koolwaterstofdampen, die behoorlijk vergelijkbaar zijn met die van ijs. vloeibaar water!
Technieken waarbij gebruik wordt gemaakt van protonen- of röntgenverstrooiing, die gewoonlijk worden gebruikt om de structuur van kristallen te bestuderen, hebben het mogelijk gemaakt de dikte te schatten op een bereik van één tot enkele honderden nanometers. Sommige onderzoeken hebben zelfs gesuggereerd dat deze dikte uiteenloopt naarmate de temperatuur de 0°C nadert.
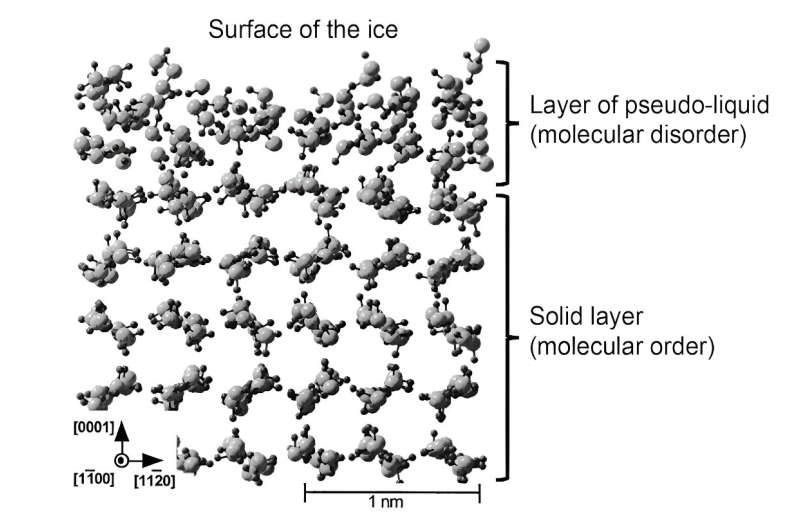
Meer recentelijk hebben simulaties het mogelijk gemaakt om de structuur van deze vloeistoflaag beter weer te geven. Vervolgens werd deze laag "pseudo-vloeistof" of "quasi-vloeistof" genoemd om deze te onderscheiden van de echte vloeibare fase. Dergelijk theoretisch werk heeft aangetoond dat de moleculen in deze oppervlaktelaag vrijer kunnen bewegen, wat de rol ervan als smeermiddel bevestigt. Toch is de moleculaire structuur niet precies dezelfde als die van vloeibaar water, wat gevolgen heeft voor de mechanische eigenschappen van deze pseudo-vloeistoflaag.
Een recente studie toonde een sterke correlatie aan tussen de individuele mobiliteit van de moleculen en de macroscopische wrijvingscoëfficiënt (hoe lager de coëfficiënt, hoe gemakkelijker het is om te glijden), wat suggereert dat het niet zozeer de dikte van de laag is die van belang is voor het glijden maar eerder de individuele beweging van de moleculen. De minimumwaarde van de wrijvingscoëfficiënt wordt gemeten bij -7°C, bekend als de optimale temperatuur voor skiërs en skaters.
Ander onderzoek ging naar het hart van de pseudo-vloeistoflaag met behulp van een nanosonde, de punt van een atoomkrachtmicroscoop. Door deze punt te laten trillen, verbonden met een uiterst nauwkeurige krachtsensor, waarbij de wrijving tussen de punt en de vloeistof in de laag werd gemeten, hebben de auteurs gemeten dat deze vloeistof 50 keer stroperiger kan zijn dan vloeibaar water, en dat deze ook elasticiteit bezit (een eigenschap meer geassocieerd met de vaste toestand). Deze viscositeit is vergelijkbaar met die van uw eetbare oliën, waardoor de pseudo-vloeibare laag een uitstekend smeermiddel is.
Samenvattend:ijs glijdt weg doordat zich op het oppervlak een vloeistoflaag van zo’n 1 tot 100 nanometer dik vormt. De mechanische eigenschappen (viscositeit, elasticiteit), die verschillen van die van vloeibaar water, en de mobiliteit van de moleculen waaruit het bestaat, die veel groter is dan die van vast ijs, geven het zijn uitzonderlijke smerende eigenschappen.
Waarom blijft ijs plakken?
De plakkerigheid van ijs blijft wetenschappers echter in verwarring brengen, ondanks zeventig jaar experimenteren. Tijdens dit laatste hebben wetenschappers de neiging om gebruik te maken van een vrij eenvoudige kit:een zuiger verbonden met een krachtsensor duwt een blok ijs voort, dat zelf aan een vast voorwerp vastzit. Wanneer het ijsblokje losbreekt, wordt de door de sensor geregistreerde kracht plotseling nul en wordt de maximale waarde vóór dit losbreken gemeten. Maar deze resultaten laten soms tegenstrijdige trends zien, en een vrij grote spreiding.
Een recent onderzoek over dit onderwerp concludeerde dat de adhesiekracht van ijs “niet alleen afhangt van de chemische samenstelling, oppervlakteruwheid, mechanische en thermische eigenschappen van het substraat [maar] ook kritisch afhangt van de temperatuur en zelfs van het experimentele apparaat om de adhesie te meten. ."
Om iets preciezer te zijn:als we de literatuur over dit onderwerp van de afgelopen 60 jaar bestuderen, merken we op dat de sterkte waarmee ijs aan een vaste stof blijft kleven, sterk afhangt van de temperatuur in een bereik tussen -20°C en 0°C ( ijs blijft harder plakken aan een koudere vaste stof). Wat de rol van oppervlakteruwheid betreft, deze is ambivalent:voor sommige vaste stoffen (vooral metalen) hecht ijs sterker aan een ruwer substraat, terwijl dit bij sommige kunststoffen precies andersom is...
Ten slotte kan vloeibaar water zich op chemisch niveau op sommige oppervlakken beter verspreiden dan op andere. Water verspreidt zich bijvoorbeeld heel goed op schoon glas, terwijl sommige oppervlakken hydrofoob zijn, zoals teflon.
Een recent onderzoek heeft aangetoond dat hoe meer water in vloeibare toestand zich over het oppervlak van een vaste stof verspreidt, hoe meer ijs zich aan deze vaste stof zal hechten. Omgekeerd zal een oppervlak met weinig affiniteit voor vloeibaar water ook weinig hechting voor ijs hebben.
Waarom deze relatie tussen de verspreiding van water en de hechting van ijs? Ten eerste moet ijs in zijn vloeibare toestand kunnen bevriezen bij contact met de vaste stof, wil ijs zich aan een koude vaste stof kunnen hechten. Hier is een eenvoudig experiment dat iedereen kan doen:
- Plaats een metalen bord in de vriezer of in uw ijsblokjeshouder.
- Neem een ijsblokje en plaats het op het bord zonder het geheel uit de vriezer te halen:het blijft niet plakken.
- Neem nog een ijsblokje en laat het lichtjes smelten op kamertemperatuur (door het bijvoorbeeld een paar seconden uit de vriezer te halen) en plaats het vervolgens op de koude plaat. Deze keer blijft het hangen!
Wat kunnen we concluderen? Intuïtief geldt:hoe groter de affiniteit van het water voor het oppervlak, hoe gemakkelijker het vloeibare water in de ruwheden en gaten op het oppervlak van de vaste stof sijpelt, waardoor het contactoppervlak tussen het water en het ijs na het stollen toeneemt, waardoor de hechting wordt geconsolideerd. Dit experiment demonstreert ook de rol van vloeibaar water als lijm. Wanneer u een conventionele lijm, bijvoorbeeld vloeibare lijm, gebruikt om twee delen met elkaar te verbinden, vindt de sterke, definitieve hechting plaats wanneer de delen stollen (door de verdamping van een oplosmiddel in de lijm). Hetzelfde gebeurt wanneer vloeibaar water afkoelt bij contact met een koude vaste stof en stolt. De laag bevroren water speelt dan de rol van een van de vaste stoffen.
Hoe kan het ijs minder klevend worden gemaakt?
We kunnen de hechting van ijs niet in detail verklaren, maar we kunnen wel proberen de sterkte ervan te verminderen. Het idee om waterafstotende behandelingen te gebruiken is natuurlijk ontstaan, maar deze behandelingen zijn in de loop van de tijd niet erg robuust en kunnen het tegenovergestelde effect hebben van wat de bedoeling was. Veelbelovendere oplossingen zijn het verspreiden van een dunne laag olie of een hydrogel over het oppervlak, maar er zijn nog steeds problemen met de stabiliteit van deze lagen over grote gebieden.
Een andere benadering is het gebruik van actieve ontdooimethoden. Een voorbeeld van zo'n techniek is oppervlakte-echografie, die "micro-aardbevingen" op het vaste oppervlak veroorzaakt en ervoor kan zorgen dat het ijs afbreekt. Momenteel bestuderen we deze methode in het MSC-laboratorium.