
Wetenschap
Wat zijn de 7 diatomische elementen?
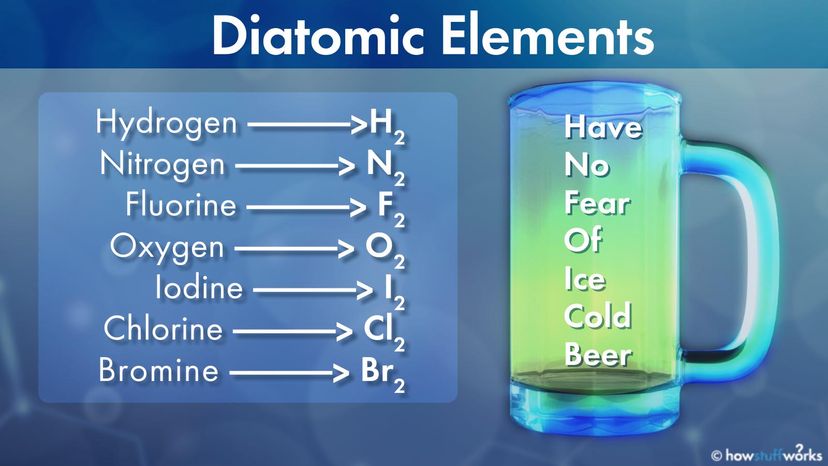
Diatomische elementen hebben er een hekel aan om alleen te zijn - zozeer zelfs dat ze gewoon niet worden gevonden als afzonderlijke atomen.
In plaats daarvan zijn het altijd twee atomen van hetzelfde zuivere element die met elkaar verbonden zijn. Het zit precies in de naam:Di - betekent "twee" en atomair betekent 'van de atomen'. En elementen zijn de basisbouwstenen van het universum.
Maar van het hele periodiek systeem zijn er slechts zeven diatomische elementen:
- Waterstof H2
- Stikstof N2
- Fluor F2
- Zuurstof O2
- Jodium I2
- Chloor Cl2
- Broom Br2
Waarom slechts zeven?
Er zijn eigenlijk maar zeven diatomische elementen. Vijf daarvan - waterstof, stikstof, fluor, zuurstof en chloor - zijn gassen bij kamertemperatuur en normale druk. Ze worden soms elementaire gassen genoemd. Broom is altijd een vloeistof, terwijl jodium bij kamertemperatuur vloeibaar of vast kan zijn, afhankelijk van een aantal factoren. Alle zeven zijn niet-metalen.
Andere elementen kunnen natuurlijk aan elkaar hechten; dat heten diatomische moleculen . Zo komen we aan tafelzout (natrium + chloor =NaCl, natriumchloride). Diatomische moleculen zoals deze worden overal gevonden. Sommige andere elementen kunnen diatomische moleculen vormen, maar de bindingen zijn erg zwak en onstabiel. Ze blijven niet lang diatomisch. Alleen deze zeven diatomische elementen vormen sterke bindingen en worden bijna altijd in deze vorm aangetroffen.
Dat wil niet zeggen dat diatomische elementen zeldzaam zijn - integendeel! Stikstof en zuurstof, in hun diatomische vorm N2 en O2 , vormen 99 procent van de atmosfeer van de aarde. Dat is het tegenovergestelde van zeldzaam.
Een gemakkelijke manier nodig om deze zeven te onthouden? Probeer dit geheugensteuntje:H ave N o F oor O f Ik ce C oude B eer. De eerste letter van elk woord herinnert je aan elk diatomisch element.
Dat is nu elementairElementen kunnen ook monoatomisch zijn, wat betekent dat er maar één atoom is. (Mon- betekent "één.") Helium is een monoatomisch element. En zuurstof kan triatomair zijn, met drie atomen aan elkaar gebonden. Dat is wat we gewoonlijk 'ozon' noemen.
 Raad voor Chemische Veiligheid staat onzekere toekomst te wachten
Raad voor Chemische Veiligheid staat onzekere toekomst te wachten Hoppig bier zonder ontploffende flessen en te veel alcohol
Hoppig bier zonder ontploffende flessen en te veel alcohol Hoe het aantal isomeren te berekenen
Hoe het aantal isomeren te berekenen  Machine learning ontdekt nieuwe sequenties om medicijnafgifte te stimuleren
Machine learning ontdekt nieuwe sequenties om medicijnafgifte te stimuleren Nanodeeltjes hebben wat ruimte nodig om energie over te dragen
Nanodeeltjes hebben wat ruimte nodig om energie over te dragen
Hoofdlijnen
- Kan gentherapie kaalheid genezen?
- Hoe u kunt helpen haaien te beschermen en wat niet werkt
- Wat voert glycolyse uit?
- Intra-rij onkruid wieden mogelijk met vision-systemen
- Waarom is UV-licht schadelijk?
- Wetenschappers ontdekken eiwitten die stamcellen in hun ongedifferentieerde staat houden
- De straal van de aarde vinden
- Planten kunnen zichzelf verdedigen door rupsen kannibaal te maken
- Schimmelmicroben als biomeststoffen in landbouw en tuinieren:is de beloning groter dan het risico?
- Cuprate-materialen hebben fluctuerende strepen die mogelijk verband houden met supergeleiding bij hoge temperaturen

- Rijstfysici RAMBO onthullen magnetisch fenomeen dat nuttig is voor kwantumsimulatie en detectie

- Onderzoekers rapporteren micro-CT-scan van een muizenembryo met ongekende resolutie
- Zoeken naar onzichtbare deeltjes met het ATLAS-experiment
- Wat is het verschil tussen luchtmijlen en zeemijlen?

 Waardoor worden woestijnen gevormd?
Waardoor worden woestijnen gevormd?  Flexibele elektronica maken met nanodraadnetwerken
Flexibele elektronica maken met nanodraadnetwerken Eerste bevindingen van kunstmatige inslag op asteroïde Ryugu
Eerste bevindingen van kunstmatige inslag op asteroïde Ryugu Standaardafwijking vinden op een TI 84 Plus
Standaardafwijking vinden op een TI 84 Plus  Waarom komt er rook uit een brand?
Waarom komt er rook uit een brand?  Synchrotron werpt licht op de amfibische levensstijl van een nieuwe roofdierdinosaurus
Synchrotron werpt licht op de amfibische levensstijl van een nieuwe roofdierdinosaurus Vijf manieren om nieuwe ouders te ondersteunen die tijdens de pandemie weer aan het werk gaan
Vijf manieren om nieuwe ouders te ondersteunen die tijdens de pandemie weer aan het werk gaan Als het leven tegen zit, bioplastic maken
Als het leven tegen zit, bioplastic maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

