
Wetenschap
Waar komt het uiteindelijke elektron in binnenovergangsmetalen binnen?
Dit is waarom:
* Binnenovergangsmetalen: Deze elementen worden gekenmerkt door het vullen van de F -orbitalen, die zich in de D -orbitalen bevinden en beschermen ze tegen de buitenste elektronen.
* 4F- en 5F -orbitalen: Deze orbitalen zijn de hoogste energieniveaus die in de respectieve periodes beschikbaar zijn. Het uiteindelijke elektron komt in deze orbitalen, wat leidt tot de unieke eigenschappen van deze elementen.
Voorbeeld:
* lanthanum (la) , het eerste lanthanide, heeft zijn uiteindelijke elektron dat de 5D -orbitaal binnengaat, maar daaropvolgende lanthaniden vullen hun 4F -orbitalen.
* actinium (AC) , de eerste actinide, heeft zijn uiteindelijke elektron dat de 6d orbital invoert, maar daaropvolgende actiniden vullen hun 5F -orbitalen.
Daarom gaat het uiteindelijke elektron in binnenovergangsmetalen altijd in de f-subshell Dat komt overeen met de periode waarin ze zich bevinden.
 Amazonebranden zorgen voor bittere discussie over wie de schuldige is
Amazonebranden zorgen voor bittere discussie over wie de schuldige is EU-luchtvaartmaatschappijen vrezen brandstofbelasting nu klimaatpush van de grond komt
EU-luchtvaartmaatschappijen vrezen brandstofbelasting nu klimaatpush van de grond komt Wat is één personificatie in het licht in het bos?
Wat is één personificatie in het licht in het bos?  winden, Overstromingen en brand:record VS voor duur weer
winden, Overstromingen en brand:record VS voor duur weer Grote overstromingen in Manilla terwijl tyfoon Filipijnen teistert
Grote overstromingen in Manilla terwijl tyfoon Filipijnen teistert
Hoofdlijnen
- Wat is een groep soorten die een enkele gemeenschappelijke voorouder en alle afstammelingen omvat?
- Waarom zijn virussen moeilijk te classificeren als levende organismen?
- Wat is een controlegroep in experimenten?
- Onderzoekers werpen licht op hoe eiwitten hun vorm vinden
- Enzymen die langs elk van de DNA -strengen bewegen tijdens replicatie die nucleotiden toevoegen aan blootgestelde bases Wat?
- Hoe de toekomst van de Amerikaanse maïs-, soja- en tarweproductie afhangt van duurzaam grondwatergebruik
- Hoe helpen stambomen ons te begrijpen hoe eigenschappen worden doorgegeven?
- Hoe behoudt de afwisseling van meiose en bemesting in levenscycli die seksueel reproducerende organismen voor elke soort normaal chromosoomtelling behouden?
- Welk molecuul is het gemeenschappelijke vertakkingspunt voor anaërobe of aerobe route?
- Een zeer gevoelige nieuwe bloedtest kan zeldzame kankereiwitten detecteren
- Nieuwe ontdekking van een zo sterke photobase, het verdient de bijnaam super

- Afstotend onderzoek:marine ontwikkelt scheepscoatings om brandstof te verminderen, energiekosten

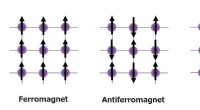
- Onderzoekers synthetiseren halfmetaal zonder magnetisatie
- Op klei gebaseerde antimicrobiële verpakking houdt voedsel vers

 Onderzoek laat zien hoe slijm microben temt
Onderzoek laat zien hoe slijm microben temt  Nieuwe nanogeneeskunde glipt door de kieren
Nieuwe nanogeneeskunde glipt door de kieren Wat beleggers hebben geleerd van de grote aardbeving
Wat beleggers hebben geleerd van de grote aardbeving  Waarom een object dat bij constante snelheid in een cirkelvormig pad beweegt, versnelling ondergaat en er kracht op heeft gepresteerd?
Waarom een object dat bij constante snelheid in een cirkelvormig pad beweegt, versnelling ondergaat en er kracht op heeft gepresteerd?  Hoe zijn voedselketens en voedselwebben gelijk en verschillend?
Hoe zijn voedselketens en voedselwebben gelijk en verschillend?  Hoeveel atomen zitten er in 600 gram ijzer?
Hoeveel atomen zitten er in 600 gram ijzer?  Als Star A derde magnitude is en B Fifth Welke helderder door welke factor?
Als Star A derde magnitude is en B Fifth Welke helderder door welke factor?  Hoe voelt kalksteen?
Hoe voelt kalksteen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

