
Wetenschap
Het iso -elektrische punt van een aminozuur is?
Hier is hoe het werkt:
* aminozuren hebben zowel zure (carboxylgroep, -cooh) als basis (aminogroep, -NH2) functionele groepen.
* Bij lage pH (zure omstandigheden) wordt de carboxylgroep geprotoneerd (-cooh) en wordt de aminogroep ook geprotoneerd (-NH3+), wat resulteert in een netto positieve lading.
* Bij hoge pH (basisomstandigheden) wordt de carboxylgroep gedeprotoneerd (-coo-) en wordt de aminogroep gedeprotoneerd (-NH2), wat resulteert in een netto negatieve lading.
* Bij een specifieke pH, het iso -elektrische punt (PI) genoemd, bestaat het aminozuur in een neutrale toestand, met een evenwicht tussen de positieve en negatieve ladingen. Dit is de zwitterionische vorm.
om de PI van een aminozuur te berekenen:
* voor aminozuren met slechts één zure en één basisgroep: De PI is gewoon het gemiddelde van de PKA -waarden van de twee groepen.
* voor aminozuren met meer dan één zure of basisgroep: De PI wordt berekend door het gemiddelde te nemen van de PKA -waarden van de twee groepen die het dichtst in PKA -waarde in de neutrale toestand staan.
Bijvoorbeeld:
* Glycine: De PKA van de carboxylgroep is 2.34 en de PKA van de aminogroep is 9,60. De pi van glycine is (2.34 + 9.60) / 2 = 5,97 .
Laat het me weten als je meer voorbeelden of een diepere uitleg van het concept wilt!
 Soorten bacteriën leven in zure pH
Soorten bacteriën leven in zure pH  Wat gebeurt er met de zoutoplossing na verdamping?
Wat gebeurt er met de zoutoplossing na verdamping?  Waarom kunnen slechts vier fosforatomen twee moleculen difosfor -trioxide produceren, zelfs als er overtollige zuurstofatomen zijn?
Waarom kunnen slechts vier fosforatomen twee moleculen difosfor -trioxide produceren, zelfs als er overtollige zuurstofatomen zijn?  Hoe kan pH uw vissen beïnvloeden?
Hoe kan pH uw vissen beïnvloeden?  Waarom wordt waterstof verzameld door neerwaartse verplaatsing van water?
Waarom wordt waterstof verzameld door neerwaartse verplaatsing van water?
 'S Werelds eerste systeem voorspelt opwarming van meren wereldwijd
'S Werelds eerste systeem voorspelt opwarming van meren wereldwijd Duurzame landbouw:opbrengst garanderen en broeikasgassen verminderen
Duurzame landbouw:opbrengst garanderen en broeikasgassen verminderen De barmhartige stad ontwerpen om ingebouwde vooroordelen te overwinnen en ons te helpen beter te leven
De barmhartige stad ontwerpen om ingebouwde vooroordelen te overwinnen en ons te helpen beter te leven Hoe verschilt de bosbodem van luifel?
Hoe verschilt de bosbodem van luifel?  Toendra verliest koolstof met snelle permafrostdooi
Toendra verliest koolstof met snelle permafrostdooi
Hoofdlijnen
- Waarom leeft schimmels?
- Waarom is Science Club belangrijk?
- Wandelstranden, vrijwilligers verzamelen gegevens over dode zeevogels
- Wat zijn de celonderdelen die zichtbaar zijn met eenvoudige samengestelde microscoop?
- Wat hebben gistcellen gemeen met plantencellen?
- Deze zomer naar het strand? Hier zijn enkele van onze beste dieren om op te letten
- Verschil tussen transcriptie en DNA-replicatie
- Wat voor soort overerving wanneer het genotype noch homozygoot of heterozygoot is?
- De eerste organismen evolueerden op aarde ongeveer 4 miljard jaar geleden fossielenrecord geeft aan dat de Were?
- Medicatie van de volgende generatie:waar chemie en rekenen elkaar ontmoeten
- Wetenschappers vinden een manier om celdood uit te stellen
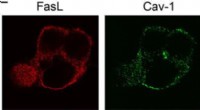
- Opvallen:ongebruikelijke magnetische overgang in perovskietoxide kan spintronica helpen stimuleren
- De kosten van ethanol verlagen, andere biobrandstoffen en benzine

- Fladderende vleugels aangedreven door de zon

 Zijn sterrenplaneten of zonnen in het universum?
Zijn sterrenplaneten of zonnen in het universum?  Wat is de nominale snelheid?
Wat is de nominale snelheid?  Waarom de Australische zomer vochtiger wordt
Waarom de Australische zomer vochtiger wordt  Nieuw ontdekt fossiel toont kleinschalige evolutionaire veranderingen in een uitgestorven menselijke soort
Nieuw ontdekt fossiel toont kleinschalige evolutionaire veranderingen in een uitgestorven menselijke soort Onderzoekers onderzoeken hoe de Antarctische ijskappen zullen reageren op de klimaatverandering en de mondiale zeespiegelstijging
Onderzoekers onderzoeken hoe de Antarctische ijskappen zullen reageren op de klimaatverandering en de mondiale zeespiegelstijging  Hoe varieert de potentiële energie in de hoogte?
Hoe varieert de potentiële energie in de hoogte?  Hoe de som van vierkanten te berekenen?
Hoe de som van vierkanten te berekenen?  Is het veilig? Waarom sommige dieren bang zijn om oversteekplaatsen voor wilde dieren te gebruiken
Is het veilig? Waarom sommige dieren bang zijn om oversteekplaatsen voor wilde dieren te gebruiken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

