
Wetenschap
Wetenschappers vinden een manier om celdood uit te stellen
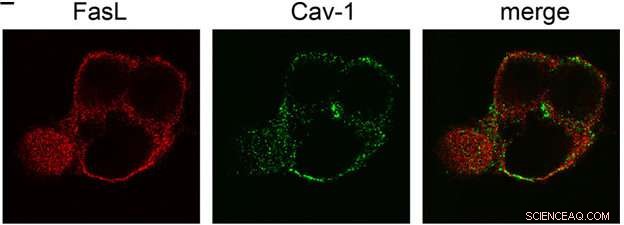
De locatie van fluorescent gelabelde Fas-liganden (Fas-L) en caveolin (Cav-1) in de cel. De laatste afbeelding is de overlap van de Fas-L en Cav-1 (samenvoegen) kanalen. Verkregen door laser confocale scanning microscopie. Krediet:Vladimir Gogvadze
Een team van wetenschappers van MSU en het Instituut voor Theoretische en Experimentele Biofysica van de Russische Academie van Wetenschappen (gevestigd in Pushchino) hebben de mechanismen bestudeerd van interactie tussen het Fas-ligand-eiwit dat celdood veroorzaakt en een respectieve membraanreceptor. Om celdood in gang te zetten, het ligand moet in contact komen met een specifieke eiwitcomponent van de cel - caveoline. Als het caveoline-bindende domein wordt verwijderd uit het molecuul Fas-ligand, celdood kan worden voorkomen. De resultaten van het onderzoek zijn gepubliceerd in Celdood en ziekte .
Fas-ligand behoort tot een groep tumornecrosefactoren. Hun belangrijkste taak is het induceren van celdood, en het proces begint na interactie met "doodsreceptoren" die zich op het oppervlak van het plasmamembraan bevinden. Het eerste contact veroorzaakt een cascade van reacties die eindigen met apoptose, een van de manieren van celdood.
"We hebben de mechanismen van de reactie tussen Fas-ligand en zijn receptor bestudeerd, en vond dat voor de stimulatie van de receptor, het membraaneiwit caveolin is vereist. Het is gehecht aan Fas-ligand, en als we het caveolin-bindende domein verwijderen, het ligand wordt aanzienlijk minder toxisch voor cellen. In onze experimenten, we gebruikten traditionele cel- en moleculair biologische methoden, " legt onderzoeker Vladimir Gogvadze uit.
In een cel, Fas-ligand is oplosbaar, of is een onderdeel van het membraan, ofwel het oversteken of er doorheen penetreren. In het laatste geval, een Fas-ligand heeft extracellulaire, intracellulair, en membraancomponenten. De extracellulaire component is verantwoordelijk voor receptorherkenning, de functies van de membraancomponent zijn slecht begrepen, en de intracellulaire component is betrokken bij transport- en signaleringsprocessen, evenals bij het transporteren van het ligand naar de membraanvlotten gevormd door moleculen van cholesterol en sfingolipiden die rond cavaeoline zijn geassembleerd. Om apoptose te activeren, de geactiveerde Fas-ligand zou deel moeten uitmaken van zo'n vlot, wat de mogelijke interacties met componenten van de membraanomgeving aangeeft.
Inderdaad, de transcriptie van de aminozuursequentie van het Fas-ligand maakte het mogelijk om de aanwezigheid van speciale domeinen te identificeren die selectief binden aan caveolin. De experimenten die werden uitgevoerd op gemuteerde cellen die dergelijke koppelingsfragmenten niet bevatten, bevestigden de veronderstelling:niet in staat om te interageren met caveolin, het Fas-eiwit verloor zijn dodelijke activiteit, en de toxiciteit ervan voor cellen nam af. Het is al bekend dat caveolin tumorontwikkeling kan onderdrukken. In het licht van de door de onderzoekers verkregen gegevens, het kan worden aangenomen dat een rol in dit proces behoort tot de link tussen caveolin en het Fas-ligand - dit mechanisme zorgt ervoor dat potentiële kankercellen apoptose ondergaan.
"De belangrijkste waarde van ons werk is het onthullen van de mechanismen van celdoodstimulatie. In de toekomst zal het helpen bij het ontwikkelen van nieuwe strategieën voor de behandeling van kanker, " besluit Vladimir Gogvadze.
 Superhydrofobe magnetische spons om water uit olieproducten te helpen zuiveren
Superhydrofobe magnetische spons om water uit olieproducten te helpen zuiveren Kankercellen kunnen over langere afstanden in het lichaam communiceren
Kankercellen kunnen over langere afstanden in het lichaam communiceren Video:kleine vormveranderende polymeren ontwikkeld voor potentiële medische toepassingen
Video:kleine vormveranderende polymeren ontwikkeld voor potentiële medische toepassingen Bacterieel cellulose-afbraaksysteem kan de productie van biobrandstoffen stimuleren
Bacterieel cellulose-afbraaksysteem kan de productie van biobrandstoffen stimuleren Kunstmatige bladeren uit het lab de lucht in verplaatsen
Kunstmatige bladeren uit het lab de lucht in verplaatsen
 Polen illegaal gekapt in oerbos:adviseur EU-rechtbank
Polen illegaal gekapt in oerbos:adviseur EU-rechtbank Welke elementen maken de lucht die we ademen?
Welke elementen maken de lucht die we ademen?  Vulkaan barst uit in de buurt van Manilla; dorpelingen vluchten, luchthavens gesloten
Vulkaan barst uit in de buurt van Manilla; dorpelingen vluchten, luchthavens gesloten Orkaan Dorian trekt richting Amerikaanse kust, zeven doden op Bahama's
Orkaan Dorian trekt richting Amerikaanse kust, zeven doden op Bahama's Seattle verbiedt plastic rietjes maar de VS heeft nog een lange weg te gaan
Seattle verbiedt plastic rietjes maar de VS heeft nog een lange weg te gaan
Hoofdlijnen
- 10 wonderkinderen
- Hightech camera helpt zeugen en biggen te beschermen
- Mobiele genetische elementen die de functie van nabijgelegen genen veranderen
- De voordelen van het hebben van een groot aantal chromosomen
- Is het waar dat als je drie weken iets doet, het een gewoonte wordt?
- Kunstmatige nesten zijn bedoeld om het broedsucces van de schuwe albatros te vergroten
- Waarom verplaatsen chloroplasten zich in Elodea?
- Kunnen we Neanderthalers terugbrengen?
- Waarom zijn er veel verschillende soorten tRNA-moleculen?
- Ontgrendelen van efficiënte licht-energieconversie met stabiele coördinatie-nanobladen

- Zwaveldioxide transformeren van schadelijk naar nuttig

- Oppervlaktetechniek krijgt het rode licht

- Groene waterstof:focus op het katalysatoroppervlak

- Nieuw onderzoek biedt uitgebreide inzichten in de reactie van de hersenen op opioïden

 Duitsland zet stappen om btw-fraude in e-commerce aan te pakken
Duitsland zet stappen om btw-fraude in e-commerce aan te pakken Jamaica vernieuwt energiebeleid voor groen COVID-19-herstel
Jamaica vernieuwt energiebeleid voor groen COVID-19-herstel Pak het licht, versla de hitte:onderzoekers ontwikkelen nieuwe infraroodcoating voor ramen
Pak het licht, versla de hitte:onderzoekers ontwikkelen nieuwe infraroodcoating voor ramen Diameter van omtrek berekenen
Diameter van omtrek berekenen Onderzoekers demonstreren afstembare bevochtiging en hechting van grafeen
Onderzoekers demonstreren afstembare bevochtiging en hechting van grafeen Nieuwe resultaten tonen aan dat materie en antimaterie op precies dezelfde manier met licht interageren
Nieuwe resultaten tonen aan dat materie en antimaterie op precies dezelfde manier met licht interageren Science Project Ideas & the Scientific Method
Science Project Ideas & the Scientific Method  wetenschappers, studenten om eerst te leven, interactieve uitzendingen van de Noordwestelijke Passage van de Noordelijke IJszee
wetenschappers, studenten om eerst te leven, interactieve uitzendingen van de Noordwestelijke Passage van de Noordelijke IJszee
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

