
Wetenschap
Wat veroorzaakt polariteit in watermolecuul?
1. Zuurstof is meer elektronegatief: Zuurstof heeft een hogere elektronegativiteit dan waterstof. Dit betekent dat het een sterkere aantrekkingskracht heeft op de gedeelde elektronen in de covalente bindingen.
2. Elektronenverdeling: Als gevolg hiervan brengen de gedeelde elektronen meer tijd dichter bij het zuurstofatoom door, waardoor het een enigszins negatieve lading heeft (Δ-).
3. waterstof wordt gedeeltelijk positief: De waterstofatomen, die enige elektronendichtheid hebben verloren, worden enigszins positief (Δ+).
4. gebogen moleculaire vorm: Het watermolecuul heeft een gebogen vorm, met de twee waterstofatomen onder een hoek van ongeveer 104,5 graden. Deze vorm verbetert de polariteit verder door de positieve en negatieve ladingen te scheiden.
De combinatie van deze factoren creëert een dipoolmoment In het watermolecuul, waar het ene uiteinde enigszins negatief is en het andere uiteinde enigszins positief is. Deze polariteit is verantwoordelijk voor veel van de unieke eigenschappen van water, waaronder:
* Sterke waterstofbinding: Watermoleculen trekken elkaar aan door sterke waterstofbruggen tussen het gedeeltelijk positieve waterstofatoom van het ene molecuul en het gedeeltelijk negatieve zuurstofatoom van een ander.
* Hoog kookpunt: De sterke waterstofbindingen vereisen aanzienlijke energie om te breken, wat leidt tot het relatief hoge kookpunt van water.
* Uitstekend oplosmiddel: Met de polariteit van het water kan het veel ionische en polaire stoffen oplossen.
* Hoge oppervlaktespanning: Watermoleculen aan het oppervlak ervaren een sterkere aantrekkingskracht op elkaar dan op de luchtmoleculen, waardoor een sterke oppervlaktespanning ontstaat.
 Wat zijn voorbeelden van vloeibare producten die per volume worden verkocht?
Wat zijn voorbeelden van vloeibare producten die per volume worden verkocht?  Nieuwe fotokatalytische methode zet biopolyolen en suikers om in methanol en syngas
Nieuwe fotokatalytische methode zet biopolyolen en suikers om in methanol en syngas Chalk and Vinegar Science Projects
Chalk and Vinegar Science Projects Onderzoekers vinden potentiële nieuwe bron van zeldzame aardelementen
Onderzoekers vinden potentiële nieuwe bron van zeldzame aardelementen Pilaarachtige moleculen als biosensoren voor metabolieten
Pilaarachtige moleculen als biosensoren voor metabolieten
 Burger King pakt klimaatverandering aan door het dieet van koeien te veranderen
Burger King pakt klimaatverandering aan door het dieet van koeien te veranderen GPM Satellite ziet Jebi als een nieuwe tropische bedreiging voor Japan
GPM Satellite ziet Jebi als een nieuwe tropische bedreiging voor Japan Netto nul? Klimaatneutraal? Heeft het jargon van klimaatverandering je in de war gebracht? Laten we het uitleggen
Netto nul? Klimaatneutraal? Heeft het jargon van klimaatverandering je in de war gebracht? Laten we het uitleggen Wat zijn de biotische factoren die dieren en planten die in toendra leven?
Wat zijn de biotische factoren die dieren en planten die in toendra leven?  Toekomstige opwarming van de oceaan verhoogt extreme tropische regenval
Toekomstige opwarming van de oceaan verhoogt extreme tropische regenval
Hoofdlijnen
- Hoe vleermuizen het menselijk brein helpen verklaren
- DNA-onderzoek van luipaarden in Zuid-Afrika traceert voorouders tot aan de ijstijd – en zal richting geven aan natuurbehoud
- Wat is de groep organellen die zowel voor plantencellen als dierencellen gebruikelijk zijn?
- Hoe werkt het zenuwstelsel samen met andere systemen?
- Wat vertelt waar de onderzoeker de bron heeft gevonden?
- Wat regelt water?
- Wat wordt gebruikt om resultaten in genetica te voorspellen?
- Neuronen leiden normaal gesproken alleen ATP af door wat?
- Wat zijn de onderdelen en functies van mitochondria?
- Hoe het proces van polymeerextrusie te optimaliseren

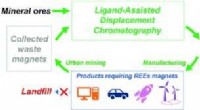
- Technologieën om te extraheren, het zuiveren van kritische zeldzame aardmetalen kan een game changer zijn
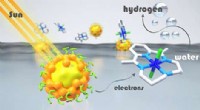
- Goedkoper, minder giftige en recyclebare lichtabsorbers voor waterstofproductie
- Onderzoekers creëren sterke, snel, waterdichte lijm

- Lichtere voertuigen maken met magnesiumlegeringen

 Hoe robots kunnen helpen bij het bestrijden van COVID-19
Hoe robots kunnen helpen bij het bestrijden van COVID-19 Oudste gevallen van borstkanker en myeloom onthuld in scans van mummies
Oudste gevallen van borstkanker en myeloom onthuld in scans van mummies Op welk type plaatgrens komen de sterkste aardbevingen voor?
Op welk type plaatgrens komen de sterkste aardbevingen voor?  Eenvoudige 10-minuten wetenschapsprojecten
Eenvoudige 10-minuten wetenschapsprojecten  Terwijl branden woeden, klimaatverandering staat weer op de verkiezingsagenda
Terwijl branden woeden, klimaatverandering staat weer op de verkiezingsagenda Welk type reactie vindt plaats wanneer een metaal corrosie ondergaat?
Welk type reactie vindt plaats wanneer een metaal corrosie ondergaat?  Onderzoekers ontdekken een oude archeologische vindplaats van de Aboriginals die op de zeebodem is bewaard
Onderzoekers ontdekken een oude archeologische vindplaats van de Aboriginals die op de zeebodem is bewaard origami, 3D-printen samenvoegen om complexe structuren in één keer te maken
origami, 3D-printen samenvoegen om complexe structuren in één keer te maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

