
Wetenschap
Hoe vormen de atomen in moleculaire verbindingen stabiele elektronenopstellingen?
1. De octetregel:
- De meeste atomen streven ernaar een volledige buitenste schaal van elektronen te hebben, meestal met acht elektronen (de octetregel).
- Uitzonderingen zijn onder meer waterstof en helium, die slechts twee elektronen nodig hebben om hun buitenste schaal te vullen.
- Het hebben van een volledige buitenste schaal zorgt voor stabiliteit en minimaliseert de reactiviteit.
2. Elektronen delen:
- Atomen bereiken deze stabiele configuratie door hun valentie -elektronen te delen (elektronen in de buitenste schaal).
- Deze gedeelde elektronen vormen een covalente binding en houden de atomen bij elkaar in een molecuul.
3. Soorten covalente bindingen:
- enkele binding: Een paar elektronen wordt gedeeld tussen twee atomen.
- Dubbele binding: Twee paar elektronen worden gedeeld.
- Triple Bond: Drie paar elektronen worden gedeeld.
4. Voorbeelden:
- water (h₂o): Zuurstof heeft 6 valentie -elektronen en heeft er nog 2 nodig om zijn octet te voltooien. Elk waterstofatoom heeft 1 valentie -elektron en heeft er nog 1 nodig. Zuurstof deelt één elektron met elk waterstofatoom en vormt twee enkele bindingen.
- Koolstofdioxide (CO₂): Koolstof heeft 4 valentie -elektronen en heeft er nog 4 nodig. Zuurstof heeft 6 valentie -elektronen en heeft er nog 2 nodig. Koolstof vormt twee dubbele bindingen met elk zuurstofatoom en deelt twee elektronen met elke zuurstof.
5. Lewis Structures:
- Lewis -structuren zijn een eenvoudige manier om covalente bindingen en elektronenregelingen weer te geven. Ze gebruiken stippen om valentie -elektronen en lijnen weer te geven om gedeelde elektronenparen (bindingen) weer te geven.
6. Polaire covalente bindingen:
- Soms worden de elektronen in een covalente binding niet gelijk gedeeld tussen de atomen.
- Dit gebeurt wanneer het ene atoom meer elektronegatief is (trekt elektronen sterker aan) dan het andere.
- Dit resulteert in een polaire binding, waarbij het ene uiteinde van de binding een enigszins negatieve lading heeft en het andere uiteinde een enigszins positieve lading heeft.
Samenvattend:
- Atomen in moleculaire verbindingen vormen stabiele elektronenopstellingen door hun valentie -elektronen te delen via covalente bindingen.
- Met dit delen kunnen atomen een volledige buitenste schaal van elektronen bereiken, die stabiliteit biedt en reactiviteit minimaliseert.
- Het type covalente binding (single, dubbel of drievoudig) hangt af van het aantal dat wordt gedeeld tussen de atomen.
- Het elektronegativiteitsverschil tussen atomen kan leiden tot polaire covalente bindingen, waarbij het ene uiteinde van de binding enigszins positief is en het andere enigszins negatief is.
 Hoeveel atomen heeft een monatomic?
Hoeveel atomen heeft een monatomic?  Verdwijningshandeling:apparaat verdwijnt op commando na militaire missies
Verdwijningshandeling:apparaat verdwijnt op commando na militaire missies Een veel voorkomende verbinding die ionisch gebonden is?
Een veel voorkomende verbinding die ionisch gebonden is?  Welk woord betekent anders en beschrijft hoe moleculen worden verdeeld in een oplossing?
Welk woord betekent anders en beschrijft hoe moleculen worden verdeeld in een oplossing?  Plastic dat de planeet redt? Nieuwe hars voor startups helpt de industrie groen te worden
Plastic dat de planeet redt? Nieuwe hars voor startups helpt de industrie groen te worden
 Tests onthullen grote variatie in overstromingsrisicomodellen
Tests onthullen grote variatie in overstromingsrisicomodellen Bosbranden kunnen drinkwater vergiftigen:zo kunnen gemeenschappen beter voorbereid zijn
Bosbranden kunnen drinkwater vergiftigen:zo kunnen gemeenschappen beter voorbereid zijn  Terwijl COVID-19 klimaatexpedities stopt, wetenschappers worstelen met onzekerheden
Terwijl COVID-19 klimaatexpedities stopt, wetenschappers worstelen met onzekerheden Beschrijf hoe Land Breezes en Sea Form?
Beschrijf hoe Land Breezes en Sea Form?  Wat bedoel je als je zegt dat noch ecologische opvolging noch natuurlijke selectie progressief is?
Wat bedoel je als je zegt dat noch ecologische opvolging noch natuurlijke selectie progressief is?
Hoofdlijnen
- Bloem of vlees? Genetica verklaart de voorkeur van muggen
- Is de menselijke soort hetzelfde als de mensheid?
- Wat is een trans-soort sprong?
- Wat is het formaat dat alleen het karakter onderstreept in een cel, niet de hele cel?
- Wat is de functie van een mitochondrea?
- Wat maakt een zoogdier tot zoogdier? Onze ruggengraat, zeggen wetenschappers
- Hoe noem je de interactie tussen organismen wanneer ze dezelfde middelen of habitat delen?
- Welke cel in het menselijk lichaam heeft de meeste midocondriën?
- Cryo-EM-beeldvorming suggereert hoe de dubbele helix scheidt tijdens replicatie
- Onderzoekers ontwikkelen nieuwe techniek voor productie van plasmonische apparaten

- Team ontwikkelt adhesiesysteem voor meerdere oppervlakken, gemodelleerd naar sprinkhanenvoeten

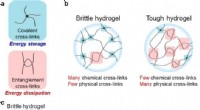
- Een universele methode om eenvoudig stevige en rekbare hydrogels te ontwerpen
- Een luchtstabiele en waterdichte lithium-metaalanode

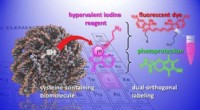
- Nieuwe chemische hulpmiddelen om biomoleculen te wijzigen en te bestuderen
 Hoe de poema uit Texas de panter uit Florida redde
Hoe de poema uit Texas de panter uit Florida redde  Röntgenstraling veroorzaakte nanobellen om kanker te bestrijden
Röntgenstraling veroorzaakte nanobellen om kanker te bestrijden Hoe wordt de biodiversiteit van een ecosysteem gemeten?
Hoe wordt de biodiversiteit van een ecosysteem gemeten?  Welke drie dingen die zowel erosie als depositie veroorzaken?
Welke drie dingen die zowel erosie als depositie veroorzaken?  Aanzetten tot haat is nog steeds gemakkelijk te vinden op sociale media
Aanzetten tot haat is nog steeds gemakkelijk te vinden op sociale media De culturele waarde van landschappen evalueren met behulp van foto's met geotags
De culturele waarde van landschappen evalueren met behulp van foto's met geotags Wat zijn EPA Phase 2-openhaard-inserts?
Wat zijn EPA Phase 2-openhaard-inserts?  China wordt 's werelds grootste octrooiaanvrager:UN
China wordt 's werelds grootste octrooiaanvrager:UN
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

