
Wetenschap
Hoe vindt geleiding plaats in metaal?
1. Het "elektronzee" -model:
* Metallic binding: Metalen hebben een unieke bindingsstructuur waarbij hun valentie -elektronen losjes gebonden zijn aan hun atomen. Dit creëert een "zee" van gedelokaliseerde elektronen die vrij door de structuur van het metaal kunnen bewegen.
* gratis elektronen: Deze elektronen zijn niet geassocieerd met een specifiek atoom en kunnen gemakkelijk migreren in het metalen rooster.
2. Hoe geleiding werkt:
* Warmte -energie: Wanneer warmte op een metaal wordt aangebracht, absorberen de vrije elektronen deze energie en beginnen ze sneller te bewegen.
* botsingen: Terwijl deze bekrachtigde elektronen bewegen, botsen ze met andere elektronen en atomen in het metaal. Deze botsingen brengen energie over en verhogen de kinetische energie van de gehele structuur.
* Warmteoverdracht: Deze overdracht van energie door het metaal is wat we als warmtegeleiding beschouwen.
3. Waarom metalen goede geleiders zijn:
* Hoge elektronendichtheid: Metalen hebben een hoge dichtheid van vrije elektronen, wat betekent dat er veel beschikbare dragers zijn voor energieoverdracht.
* Zwakke elektronenbinding: De gedelokaliseerde elektronen zijn zwak gebonden aan de metaalatomen, waardoor ze vrij en efficiënt kunnen verplaatsen.
Samenvattend:
Metalen zijn uitstekende warmtegeleiders omdat ze een "zee" van vrije elektronen hebben die gemakkelijk warmte -energie absorberen en overbrengen door botsingen in de metaalstructuur. Dit proces is veel efficiënter dan in andere materialen waar elektronen strak gebonden zijn aan individuele atomen.
 Schoonmaakster maken, groener, milieuvriendelijke zonnebrandcrème
Schoonmaakster maken, groener, milieuvriendelijke zonnebrandcrème Welk type binding houdt de basen dichter bij elkaar?
Welk type binding houdt de basen dichter bij elkaar?  Redoxdivergente strategie voor constructie van (dihydro)thiofenen met dimethylsulfoxide
Redoxdivergente strategie voor constructie van (dihydro)thiofenen met dimethylsulfoxide Waarom breng je verf aan op een ijzeren artikelen?
Waarom breng je verf aan op een ijzeren artikelen?  Waarom krijgt natrium geen van de symbolen S of N?
Waarom krijgt natrium geen van de symbolen S of N?
 Wetenschappers ontwikkelen eerste 3D-massaschatting van microplasticvervuiling in Lake Erie
Wetenschappers ontwikkelen eerste 3D-massaschatting van microplasticvervuiling in Lake Erie Wat drijft de enorme bloemen van bruin zeewier die zich opstapelen op de stranden van Florida en de Caraïben?
Wat drijft de enorme bloemen van bruin zeewier die zich opstapelen op de stranden van Florida en de Caraïben? Zal de rol van de VS bij klimaatbesprekingen veranderen na een storm?
Zal de rol van de VS bij klimaatbesprekingen veranderen na een storm?  Onderzoek bevestigt het reinigend vermogen van micro-algen in afvalwaterzuivering
Onderzoek bevestigt het reinigend vermogen van micro-algen in afvalwaterzuivering Rapport vindt verbeteringen in de algehele gezondheid van Chesapeake Bays
Rapport vindt verbeteringen in de algehele gezondheid van Chesapeake Bays
Hoofdlijnen
- Welke structuren in het blad bevatten alle belangrijke organen?
- Wat betekent het als een cel selectief permeabel is?
- Welke verklaring verklaart Mendels -observaties over hoe eigenschappen van generatie op generatie worden doorgegeven?
- Wat is het woord dat wordt gebruikt om de vorm van plantencellen te beschrijven?
- Hoe grootte cellen splitst:Cellen meten het oppervlak om te weten wanneer ze delen
- Wat zijn planten en schimmels die gedijen op dode weefsels van planten en dieren?
- Hoe komen zuurstof- en spijsverteringsvoeding in uw lichaamscellen?
- Wat is de wetenschappelijke naam voor een shag met blauwe ogen?
- Wat doen wetenschappers om een hypothese te testen?
- Productie van vuile keramische tegels opruimen

- Hoe de mal de kristallijne structuur van chocoladerepen beïnvloedt

- Onderzoekers passen voor het eerst 2D-spectroscopie toe op geïsoleerde moleculaire systemen
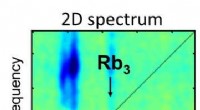
- Ammoniak breken:een nieuwe katalysator om bij lage temperaturen waterstof te maken uit ammoniak

- Structurele inzichten in kleine bacteriële harpoenen
 Hoe cellen 'klimmen' om luchtpijpen van fruitvliegjes te bouwen
Hoe cellen 'klimmen' om luchtpijpen van fruitvliegjes te bouwen  Belangrijke keuzes van universiteiten kunnen loonverschillen tussen mannen en vrouwen voorspellen
Belangrijke keuzes van universiteiten kunnen loonverschillen tussen mannen en vrouwen voorspellen Eenvoudig proces haalt waardevol magnesiumzout uit zeewater
Eenvoudig proces haalt waardevol magnesiumzout uit zeewater Wat is een substraat in de chemie?
Wat is een substraat in de chemie?  Leg twee manieren uit waarop een echte beweging door de ruimte zich vertaalt die zich van de aarde waarneemt?
Leg twee manieren uit waarop een echte beweging door de ruimte zich vertaalt die zich van de aarde waarneemt?  Is CACL2 een moleculaire formule of eenheid?
Is CACL2 een moleculaire formule of eenheid?  Koningin of arbeider? Flexibiliteit tussen rollen is afhankelijk van slechts een paar genen
Koningin of arbeider? Flexibiliteit tussen rollen is afhankelijk van slechts een paar genen  Wat is de bron van vrijwel alle energie op aarde?
Wat is de bron van vrijwel alle energie op aarde?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

