
Wetenschap
Waarom worden metalen beschouwd als geleiders?
1. Zee van elektronen:
* Structuur: In tegenstelling tot niet-metalen waar elektronen strak gebonden zijn aan individuele atomen, hebben metalen een "zee" van gedelokaliseerde elektronen. Deze elektronen zijn niet geassocieerd met een bepaald atoom en zijn vrij om door de gehele metaalstructuur te bewegen.
* Mobiliteit: Deze zee van elektronen zorgt voor een gemakkelijke laadbeweging, waardoor metalen uitstekende elektriciteitsgeleiders worden.
2. Gratis elektronen:
* energieniveaus: De buitenste valentie -elektronen in metalen zijn slechts zwak gebonden aan hun atomen. Ze hebben hoge energieniveaus en kunnen gemakkelijk worden opgewonden naar hogere energietoestanden.
* geleiding: Wanneer een elektrisch veld wordt aangebracht, kunnen deze vrije elektronen gemakkelijk bewegen in reactie op het veld, met de elektrische stroom.
3. Metallic binding:
* Structuur: Metaalbindingen komen voort uit de aantrekkingskracht tussen positief geladen metaalionen en de omringende zee van gedelokaliseerde elektronen.
* geleidbaarheid: Deze sterke attractie zorgt ervoor dat de elektronen vrij blijven om te bewegen, wat bijdraagt aan de hoge geleidbaarheid van metalen.
4. Andere factoren:
* Temperatuur: Terwijl metalen uitstekende geleiders zijn bij kamertemperatuur, neemt hun geleidbaarheid af naarmate de temperatuur toeneemt. Dit komt omdat verhoogde thermische energie meer botsingen tussen elektronen en ionen veroorzaakt, waardoor hun stroom wordt belemmerd.
Samenvattend: Het vrije verkeer van elektronen in de structuur "Zee van elektronen" van metalen maakt ze uitzonderlijk goede geleiders van zowel elektriciteit als warmte. Deze eigenschap maakt ze van onschatbare waarde in veel toepassingen, van elektrische bedrading en elektronica tot koellichamen en kookgerei.
 Klimaatverandering gaat echt over welvaart, vrede, volksgezondheid en nageslacht
Klimaatverandering gaat echt over welvaart, vrede, volksgezondheid en nageslacht Waarom kunnen we niet allemaal met elkaar overweg zoals de veehouders en de wilde dieren in Namibië?
Waarom kunnen we niet allemaal met elkaar overweg zoals de veehouders en de wilde dieren in Namibië?  De wereldwijde CO2-uitstoot kan met drie procent worden verminderd door het voorbeeld van het VK te volgen
De wereldwijde CO2-uitstoot kan met drie procent worden verminderd door het voorbeeld van het VK te volgen China's afvalverbod zet Amerikaanse recycling op z'n kop - is het tijd om verbranding te heroverwegen?
China's afvalverbod zet Amerikaanse recycling op z'n kop - is het tijd om verbranding te heroverwegen? Welke vijanden hebben wasberen?
Welke vijanden hebben wasberen?
Hoofdlijnen
- Welk weefsel in een plant absorbeert water?
- Naam voor een reeks DNA -basen die één eiwit coderen?
- Wat zijn alle biomen in Alaska?
- Wat is de structuur en functie van ATP?
- Is regeneratieve landbouw een eco-wake-up call?
- Wat is bio-getransformeerd?
- Wat is een voorbeeld van een protistenorganisme?
- Team laat zien hoe vrouwelijke spinnen een actieve rol spelen bij de verkering
- Waar gebruiken uw cellen of organen koolhydraten voor?
- Nieuw gebruik van NMR werpt licht op eenvoudig te maken elektrogepolymeriseerde katalysatoren

- Licht werpen op een schimmige organisatorische hub in cellen
- Nieuw model beschrijft fasescheiding die antilichaamoplossingen bederft
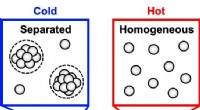
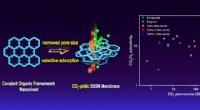
- Eenfasige covalente organische raamwerkmembranen maken CO2-selectieve scheiding mogelijk
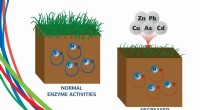
- Zware metalen maken bodemenzymen 3 keer zwakker
 Wat is de naam voor samengestelde C3H7OH?
Wat is de naam voor samengestelde C3H7OH?  Wat is de bijdrage van Alexandeer Graham Bell aan natuurkunde?
Wat is de bijdrage van Alexandeer Graham Bell aan natuurkunde?  Impact van weg en spoor op verstedelijkingsdaling
Impact van weg en spoor op verstedelijkingsdaling Onderzoek naar extracellulaire blaasjes schetst nieuwe strategieën om neurodegeneratieve ziekten te bestrijden
Onderzoek naar extracellulaire blaasjes schetst nieuwe strategieën om neurodegeneratieve ziekten te bestrijden  Welk deel van een komeet verdampt na vele reizen rond de zon?
Welk deel van een komeet verdampt na vele reizen rond de zon?  Aardbevingen en tsunami's in Europa?
Aardbevingen en tsunami's in Europa?  De dwingende wiskundige uitdaging van het drielichamenprobleem
De dwingende wiskundige uitdaging van het drielichamenprobleem Wat is de samengestelde naam voor CH300H?
Wat is de samengestelde naam voor CH300H?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

