
Wetenschap
Vormen de overgangsmetalen kationen of anionen?
Dit is waarom:
* Elektronenconfiguratie: Overgangsmetalen hebben een gedeeltelijk gevulde D orbital. Ze hebben de neiging om elektronen van hun S- en D -orbitalen te verliezen om een stabielere elektronenconfiguratie te bereiken. Dit verlies van elektronen resulteert in de vorming van positief geladen ionen (kationen).
* elektropositiviteit: Overgangsmetalen zijn over het algemeen elektropositief, wat betekent dat ze de neiging hebben om elektronen te verliezen en positieve ionen te vormen.
* Oxidatie stelt: Overgangsmetalen vertonen variabele oxidatietoestanden, wat een direct gevolg is van hun vermogen om verschillende aantallen elektronen te verliezen.
Voorbeelden:
* IJzer (Fe) vormt Fe²⁺ en Fe³⁺ Cations.
* Koper (Cu) vormt Cu⁺ en Cu²⁺ kationen.
* Zink (Zn) vormt Zn²⁺ kationen.
Uitzonderingen:
* Sommige overgangsmetalen kunnen anionen vormen in specifieke omstandigheden. Mangaan (MN) kan bijvoorbeeld het MNO₄⁻ (permanganaat) anion vormen.
De vorming van anionen door overgangsmetalen komt echter minder vaak voor dan de vorming van kationen.
 100 procent biobased, transparant, en thermisch stabiel polyamide
100 procent biobased, transparant, en thermisch stabiel polyamide Hoeveel atomen zijn er in 5,0 mol Fe?
Hoeveel atomen zijn er in 5,0 mol Fe?  Wordt een vaste stof veranderd van vloeistof naar gasfysische of chemische verandering?
Wordt een vaste stof veranderd van vloeistof naar gasfysische of chemische verandering?  Welk metaalelement is een giftig vloeibaar metaal?
Welk metaalelement is een giftig vloeibaar metaal?  Superresolutiemicroscopie:nog dichter bij de limiet komen
Superresolutiemicroscopie:nog dichter bij de limiet komen
 Megadroughs hielpen oude rijken omver te werpen. Ze zijn in het verleden van Australië, en er komen er nog meer
Megadroughs hielpen oude rijken omver te werpen. Ze zijn in het verleden van Australië, en er komen er nog meer Hoe zal COVID-19 er in de verre toekomst voor geologen uitzien?
Hoe zal COVID-19 er in de verre toekomst voor geologen uitzien? Hoe belangrijk is geografische isolatie bij soortvorming?
Hoe belangrijk is geografische isolatie bij soortvorming?  Met klimaatverandering minder duidelijk in Midwest, parkbezoekers willen weten hoe lokale hulpbronnen worden beïnvloed
Met klimaatverandering minder duidelijk in Midwest, parkbezoekers willen weten hoe lokale hulpbronnen worden beïnvloed De weg verlichten om water uit de lucht te halen
De weg verlichten om water uit de lucht te halen
Hoofdlijnen
- Waarom wordt blauwe groene algen beschouwd als een verbindingsverbinding tussen lagere en hogere dieren?
- Wanneer sporen ontkiemen, welke generatie ontwikkelt zich?
- Hoe vormen zich cellen tot organen?
- Uit bevindingen blijkt hoe het dengue-virus volwassen wordt en besmettelijk wordt
- Genetici ontdekken twee verschillende manieren om transcriptie te beëindigen
- Wat wordt gebruikt om het grootste deel van structurele en functionele celstoffen zoals collageen enzymen hemoglobine te maken?
- Wat gebeurt er met planten en dierlijke cellen bij plaatsing in hypertonische, hypotone en isotone omgevingen?
- Hoe weten wetenschappers wat er in dinosauruseieren zit?
- Wat betekent replicatie in de biologie?
- Moleculair jodium katalyseert processen voor antivirale en farmaceutische syntheses
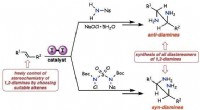
- Elektrochemische synthese van formiaat uit koolstofdioxide met behulp van een tin/gereduceerde grafeenoxidekatalysator

- Nieuwe brandstofceltechnologie draait op vaste koolstof

- Met nanoporie-detectie, natuurkundigen detecteren subtiele veranderingen in afzonderlijke deeltjes
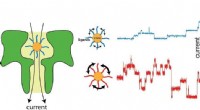
- Computermodellen bieden nieuw begrip van sikkelcelziekte
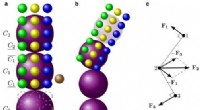
 Wie zijn de beste tweeters? UCF-afgestudeerden hebben een trackingsite gemaakt
Wie zijn de beste tweeters? UCF-afgestudeerden hebben een trackingsite gemaakt  Toyota gaat Lexus in Canada assembleren:Trudeau
Toyota gaat Lexus in Canada assembleren:Trudeau Hoe Nieuw-Zeeland de uitstoot sneller kan verminderen en minder afhankelijk kan zijn van compensaties om netto nul te bereiken
Hoe Nieuw-Zeeland de uitstoot sneller kan verminderen en minder afhankelijk kan zijn van compensaties om netto nul te bereiken Polymeer nanodraden die in loodrechte lagen worden samengevoegd, kunnen een weg bieden naar kleinere chipcomponenten
Polymeer nanodraden die in loodrechte lagen worden samengevoegd, kunnen een weg bieden naar kleinere chipcomponenten Zal een object een grotere schijnbare massa in lucht of vacuüm hebben?
Zal een object een grotere schijnbare massa in lucht of vacuüm hebben?  Onderzoekers melden doorbraak die praktische halfgeleiderspintronica mogelijk maakt
Onderzoekers melden doorbraak die praktische halfgeleiderspintronica mogelijk maakt De vorm van het watermolecuul H2O?
De vorm van het watermolecuul H2O?  Suomi NPP Satellite ziet Norman snel intensiveren
Suomi NPP Satellite ziet Norman snel intensiveren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

