
Wetenschap
Wat gebeurt er als een waterstofatoom verandert van de opgewonden toestand naar grondtoestand?
1. Energie -emissie: Het elektron in de geëxciteerde toestand heeft een hoger energieniveau dan in de grondtoestand. Om terug te keren naar de grondtoestand, moet het elektron deze overtollige energie verliezen. Deze energie wordt vrijgegeven in de vorm van A foton , een pakje elektromagnetische straling.
2. Fotonkenmerken: De energie van het uitgezonden foton is precies gelijk aan het verschil in energie tussen de opgewonden toestand en de grondtoestand. Dit energieverschil bepaalt de frequentie en golflengte van het uitgezonden foton.
3. Spectrale lijnen: De uitgezonden fotonen kunnen worden waargenomen als spectrale lijnen in het elektromagnetische spectrum. Elke overgang tussen specifieke energieniveaus komt overeen met een unieke spectrale lijn. Dit is de basis van atomaire spectroscopie , waarmee wetenschappers elementen kunnen identificeren en hun eigenschappen bestuderen.
4. Ontspanning: Na het uitstoot van het foton vestigt het elektron zich in de grondtoestand, het laagste energieniveau. Dit is de meest stabiele configuratie voor het waterstofatoom.
Samenvattend:
* Het elektron verliest energie.
* Een foton wordt uitgezonden.
* Het uitgezonden foton heeft specifieke energie, frequentie en golflengte.
* Het waterstofatoom keert terug naar zijn grondtoestand.
Dit proces is van fundamenteel belang om het gedrag van atomen en de interacties van licht en materie te begrijpen.
 Brachiopoden die bestand zijn tegen veranderingen in het milieu in het verleden
Brachiopoden die bestand zijn tegen veranderingen in het milieu in het verleden Het oudste ijs op aarde kan mogelijk de puzzel van de klimaatgeschiedenis van de planeten oplossen
Het oudste ijs op aarde kan mogelijk de puzzel van de klimaatgeschiedenis van de planeten oplossen Studie van boomringen biedt meer bewijs van poolwaartse migratie van tropische stormen
Studie van boomringen biedt meer bewijs van poolwaartse migratie van tropische stormen Milieuvervuiling en menselijke gezondheid – hoe bezorgd moeten we ons maken?
Milieuvervuiling en menselijke gezondheid – hoe bezorgd moeten we ons maken?  Krachtige aardbeving schudt Indonesië, maar geen slachtoffers gemeld
Krachtige aardbeving schudt Indonesië, maar geen slachtoffers gemeld
Hoofdlijnen
- Morfogenese in planten is het gevolg van wat?
- Wat is een standaard DNA -grootte en waarom deze wordt gebruikt in gelelektroforese?
- Terugkijken op de geschiktheid van het verhaal over het economisch beleid dat ten grondslag ligt aan de Groene Revolutie
- Hoe de bescherming van de gezondheid van planten essentieel is voor toekomstige welvaart en duurzaamheid
- Waarom solitaire reptielen eieren leggen in gemeenschappelijke nesten
- Waarom bestaan antigenen uit eiwitten?
- De modificeert eiwitten geleverd van het ruwe endoplasmatische reticulum.
- Wat is de gebruikelijke reactie in de populatiegrootte van veel soorten?
- Welk orgaansysteem transporteert voedingsstoffen naar alle cellen?
- Wetenschappers gaan diep om de eigenschappen van perovskiet te kwantificeren

- CO2 omzetten in bruikbare energie

- 'S Werelds eerste ultrasone biosensor gemaakt in Australië
- Chemici zetten titanium nanodeeltjes om in een efficiënt wapen tegen vervuiling
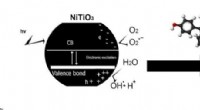
- Nieuwe röntgenmethode heeft ingrijpende gevolgen voor de ontwikkeling van levensreddende medicijnen
 NASA vangt de ontwikkeling van de tropische storm Vicky . in de oostelijke Atlantische Oceaan
NASA vangt de ontwikkeling van de tropische storm Vicky . in de oostelijke Atlantische Oceaan Hoe een badkamer in één dag 3D te printen?
Hoe een badkamer in één dag 3D te printen? Waar is de chemische energie in een opgeslagen materiaal?
Waar is de chemische energie in een opgeslagen materiaal?  Optimalisatie van winglets voor minimale weerstand, efficiëntere vlucht
Optimalisatie van winglets voor minimale weerstand, efficiëntere vlucht De mensheid heeft het ozongat genezen. Kunnen we hetzelfde doen voor de klimaatverandering?
De mensheid heeft het ozongat genezen. Kunnen we hetzelfde doen voor de klimaatverandering?  Wat is de naam van chemische formule Babro2?
Wat is de naam van chemische formule Babro2?  Eens in de eeuw bloeien en zaaien van dwergbamboe verhoogt de muizenpopulaties
Eens in de eeuw bloeien en zaaien van dwergbamboe verhoogt de muizenpopulaties Waarom dalende objecten een constante snelheid hebben?
Waarom dalende objecten een constante snelheid hebben?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

