
Wetenschap
Wat versnelt de reactie en vertraagt de reactie?
factoren die reacties versnellen
* Temperatuur: Hogere temperaturen bieden moleculen met meer kinetische energie, wat leidt tot frequentere en energetische botsingen, waardoor de kans op reacties toeneemt.
* concentratie: Hogere concentraties reactanten betekenen dat er meer moleculen beschikbaar zijn om te botsen, waardoor de reactiesnelheid wordt verhoogd.
* oppervlakte: Voor reacties waarbij vaste stoffen betrokken zijn, toont het verhogen van het oppervlak (bijvoorbeeld het breken van een vaste stof in kleinere stukken) meer reactantmoleculen bloot aan interactie, waardoor het proces wordt versneld.
* katalysator: Een katalysator is een stof die een reactie versnelt zonder tijdens het proces te worden geconsumeerd. Katalysatoren bieden een alternatieve reactieroute met lagere activeringsenergie.
* druk (voor gassen): Toenemende druk voor reacties waarbij gassen betrokken zijn, verhoogt de concentratie van reactanten, wat leidt tot meer botsingen en een snellere snelheid.
factoren die reacties vertragen
* Temperatuur: Lagere temperaturen verminderen de kinetische energie van moleculen, wat leidt tot minder botsingen en een langzamere reactiesnelheid.
* concentratie: Lagere concentraties reactanten verminderen het aantal beschikbare moleculen om te botsen, waardoor de reactie wordt vertraagd.
* remmer: Een remmer is een stof die vertraagt of een reactie voorkomt. Remmers kunnen de actieve plaats van een katalysator blokkeren of het reactiemechanisme verstoren.
* druk (voor gassen): Afnemende druk voor reacties waarbij gassen betrokken zijn, vermindert de concentratie van reactanten, wat resulteert in minder botsingen en een langzamere snelheid.
Key Concepts
* Activeringsenergie: De minimale hoeveelheid energie die nodig is om een reactie te laten optreden. Katalysatoren lagere activeringsenergie, waardoor reacties sneller optreden.
* Botsingstheorie: Om een reactie te laten optreden, moeten reactantmoleculen botsen met voldoende energie en in de juiste oriëntatie.
voorbeelden
* versnellen: Door voedsel te koken bij een hogere temperatuur zorgt ervoor dat het sneller koken. Met behulp van een open haard van hout om een kampvuur (katalysator) te starten.
* Vertragend: Het opslaan van voedsel in de koelkast vertraagt de bederf (lagere temperatuur). Een conserveermiddel toevoegen aan voedsel (remmer).
Laat het me weten als je meer informatie wilt over een van deze factoren!
 Laat het regenen! Nieuwe coatings maken natuurlijke stoffen waterdicht
Laat het regenen! Nieuwe coatings maken natuurlijke stoffen waterdicht Door grote stille genen op te heffen, kunnen bacteriën nieuwe moleculen produceren, potentiële kandidaat-geneesmiddelen
Door grote stille genen op te heffen, kunnen bacteriën nieuwe moleculen produceren, potentiële kandidaat-geneesmiddelen Bij de volledige verbranding van C3H8O3 hoeveel koolstofdioxide wordt er geproduceerd wanneer 23,0 g brandwonden?
Bij de volledige verbranding van C3H8O3 hoeveel koolstofdioxide wordt er geproduceerd wanneer 23,0 g brandwonden?  Wat is de samengestelde mg2p2?
Wat is de samengestelde mg2p2?  Deeltjes van alledaagse muurverven kunnen levende organismen schaden, maar een nieuw membraan vertoont hoge filtereffecten
Deeltjes van alledaagse muurverven kunnen levende organismen schaden, maar een nieuw membraan vertoont hoge filtereffecten
 Dode zone van de Golf van Mexico veel kleiner dit jaar
Dode zone van de Golf van Mexico veel kleiner dit jaar Kunnen we onze sequoia's en vuurlelies redden van klimaatverandering?
Kunnen we onze sequoia's en vuurlelies redden van klimaatverandering? Combinatie van El Nino en de aardbeving in Ecuador in 2016 heeft de uitbraak van Zika waarschijnlijk verergerd
Combinatie van El Nino en de aardbeving in Ecuador in 2016 heeft de uitbraak van Zika waarschijnlijk verergerd Recordbrekende Alpenkaart stuurt boodschap tegen klimaatverandering
Recordbrekende Alpenkaart stuurt boodschap tegen klimaatverandering Hoe ademt een rivier? Het antwoord zou kunnen leiden tot een beter begrip van de mondiale koolstofcyclus
Hoe ademt een rivier? Het antwoord zou kunnen leiden tot een beter begrip van de mondiale koolstofcyclus
Hoofdlijnen
- Wat is het zenuwstelsel van het menselijk lichaam?
- Wie bestudeert de relatie tussen organismen en hun omgeving?
- Wat is het verschil tussen diffusie en osmose?
- Welke gasplanten en dieren gebruiken is een product van fotosynthese?
- Welke sympatrische speciatie door polyploïdie is een frequent fenomeen geweest in de evolutie van.
- Wat maakt een goede boer in Aotearoa?
- Studie onthult hoe bacteriën oude mechanismen gebruiken om zichzelf te herstellen
- Hagedis in je bagage? We gebruiken kunstmatige intelligentie om de handel in wilde dieren en planten op te sporen
- Isoleert het het axon van neuron?
- Handheld-gadget voor snelle tests van de voedselkwaliteit

- NREL onderzoekt coatings die nodig zijn voor het concentreren van zonne-energie

- Vooruitgang in cryo-EM-materialen kan kanker en biomedisch onderzoek helpen

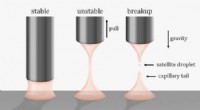
- Een nieuwe draai om visco-elastische vloeistofbruggen te doorbreken
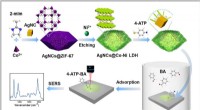
- Nieuwe SERS-sensor helpt bij het detecteren van aldehydegassen
 Hoeveel gram zijn er in 2 gallons?
Hoeveel gram zijn er in 2 gallons?  Welke van de volgende zijn gelijk aan -40 graden F?
Welke van de volgende zijn gelijk aan -40 graden F?  Wat kunt u bepalen uit niet -verspreide rotslagen en waar zou de oudste jongste rots vinden?
Wat kunt u bepalen uit niet -verspreide rotslagen en waar zou de oudste jongste rots vinden?  Hoe de IR van methyl m-Nitrobenzoaat
Hoe de IR van methyl m-Nitrobenzoaat Koolstofbewust:hoe een man zijn voetafdruk verkleint
Koolstofbewust:hoe een man zijn voetafdruk verkleint Economen vinden nieuwe redenen om te denken dat de omgeving, en niet het aangeboren vermogen, bepaalt hoe goed meisjes het doen in de wiskundeles
Economen vinden nieuwe redenen om te denken dat de omgeving, en niet het aangeboren vermogen, bepaalt hoe goed meisjes het doen in de wiskundeles  Wat infecteert en vernietigt T -cellen van het immuunsysteem?
Wat infecteert en vernietigt T -cellen van het immuunsysteem?  Hoe werken manometers?
Hoe werken manometers?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

