
Wetenschap
Het bestaan van resonantie maakt een molecuul minder stabiel dan anders het geval zou zijn?
* Resonantiestructuren: Resonantie beschrijft een situatie waarin de ware structuur van een molecuul niet kan worden weergegeven door een enkele Lewis -structuur. In plaats daarvan is het een hybride van meerdere bijdragende structuren (resonantiestructuren), die elk slechts een gedeeltelijke weergave van het echte molecuul zijn.
* Elektronendelocalisatie: Resonantiestructuren geven de delocalisatie van elektronen over meerdere atomen weer. Dit betekent dat elektronen niet beperkt zijn tot een enkele binding of atoom, maar vrij over het molecuul kunnen bewegen.
* Verhoogde stabiliteit: Gedelokaliseerde elektronen zijn stabieler dan gelokaliseerde elektronen. Dit komt omdat gedelokaliseerde elektronen minder snel worden aangetrokken door positief geladen kernen, wat leidt tot lagere energie en een grotere stabiliteit.
Denk er zo aan:
Stel je een touw voor gebonden aan een paal. Als het touw statisch is, is het gemakkelijk getrokken. Maar als je het touw schudt, wordt de energie verspreid over de lengte, waardoor het beter bestand is tegen getrokken. Evenzo hebben gedelokaliseerde elektronen in een molecuul hun energie verspreid, waardoor het molecuul stabieler wordt.
Voorbeeld:
Overweeg het benzeenmolecuul (C6H6). Het wordt weergegeven door een ring met afwisselende dubbele en enkele bindingen. Dit is echter slechts een vereenvoudigde weergave. In werkelijkheid worden de elektronen in de PI -bindingen over de hele ring gedelokaliseerd, waardoor het veel stabieler wordt dan wanneer het gelokaliseerde dubbele bindingen had.
Daarom draagt resonantie bij aan verhoogde stabiliteit, niet verminderde stabiliteit van een molecuul.
 Veldgevoelige mechanische metamaterialen (FRMM's)
Veldgevoelige mechanische metamaterialen (FRMM's) In welke van de volgende reacties zou u verwachten dat de oriëntatiefactor het minst belangrijk is bij de leidende reactie is het h plus CL -oplevert HCl of NO O NO2?
In welke van de volgende reacties zou u verwachten dat de oriëntatiefactor het minst belangrijk is bij de leidende reactie is het h plus CL -oplevert HCl of NO O NO2?  Hoe ziet de zijkant van het zilveren dubbeltje uit 1965 eruit?
Hoe ziet de zijkant van het zilveren dubbeltje uit 1965 eruit?  Hoe verschillen deeltjes in oplossingen van die suspensie?
Hoe verschillen deeltjes in oplossingen van die suspensie?  Wat zijn de soorten biologisch afbreekbare polymeer?
Wat zijn de soorten biologisch afbreekbare polymeer?
 NASA's Terra Satellite ziet de geboorte van tropische storm Imelda
NASA's Terra Satellite ziet de geboorte van tropische storm Imelda De minister van Gabon begroet de verantwoordelijkheid van het land na historische bosdeal
De minister van Gabon begroet de verantwoordelijkheid van het land na historische bosdeal Opwarming om onweersbuien groter en frequenter te maken (update)
Opwarming om onweersbuien groter en frequenter te maken (update) Landbedekking vanuit de ruimte identificeren:methoden voor machinaal leren bieden gedetailleerde informatie over gewastypen
Landbedekking vanuit de ruimte identificeren:methoden voor machinaal leren bieden gedetailleerde informatie over gewastypen Instorting van het milieu of duurzame toekomst?
Instorting van het milieu of duurzame toekomst?
Hoofdlijnen
- Wat is een microscopisch kleine eencellige, eenvoudige plant, waarvan sommige schadelijk en nuttig zijn om te vormen?
- Wat zijn verschillende soorten laboratoriumapparatuur en hun betekenis?
- Resulteert melosis in 2 haploïde cellen?
- Hoe wordt het genoemd als het ei en sperma versmelten buiten het lichaam?
- Zal een goed gemengd, warmer meer invasieve vissen verdoemen?
- Waarom is het noodzakelijk om het chromosoom aantal gameten te verminderen, maar geen andere cellen een organisme?
- Wat is het RNA van een plantencel?
- Onderzoekers ontdekken een mechanisme dat de kiemrust in boompioenen reguleert
- Hoe helpen de flagella bacteriën rond te bewegen?
- MagLab-wetenschappers ontdekken thermo-elektrische eigenschappen in veelbelovende materiaalklasse

- Nieuwe geautomatiseerde biologische monsteranalysesystemen om ziektedetectie te versnellen

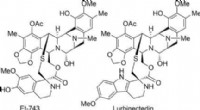
- Totale synthese van mariene antitumormiddelen trabectedine en lurbinectedine
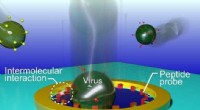
- Nieuwe virale identificatiemethode ontwikkeld
- Elektronische tong zorgt voor de snelle, goedkope detectie van vervalste honing

 Wat doet Astrolabe?
Wat doet Astrolabe?  Wat is een urologiekanaal?
Wat is een urologiekanaal?  Archaea bevat aanwijzingen voor oude oceaantemperaturen
Archaea bevat aanwijzingen voor oude oceaantemperaturen Wat zijn de sterke punten van de biogenesetheorie?
Wat zijn de sterke punten van de biogenesetheorie?  Waar kan de tektonische in MOO GX worden gevonden?
Waar kan de tektonische in MOO GX worden gevonden?  Wat is de rol van deeltjes bij overdrachtswarmte?
Wat is de rol van deeltjes bij overdrachtswarmte?  Is de zonstraling of geleiding?
Is de zonstraling of geleiding?  Wat dacht hij? Studie wendt zich tot apenintellect
Wat dacht hij? Studie wendt zich tot apenintellect
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

