
Wetenschap
Wat zijn de temperatuurgassen op nul volume?
* Ideale gaswet: De ideale gaswet (PV =NRT) beschrijft de relatie tussen druk (P), volume (V), aantal mol (N), temperatuur (T) en de ideale gasconstante (R). Deze wet is een goede benadering voor veel gassen onder normale omstandigheden.
* nul volume: Een gas met nul volume zou betekenen dat alle moleculen samen worden verpakt zonder ruimte daartussen. Dit is onmogelijk omdat moleculen een eindige grootte hebben en ze elkaar afstoten.
* Het bereiken van absolute nul: Volgens de ideale gaswet, als het volume zou afnemen tot nul, zou de temperatuur absolute nul moeten bereiken (-273,15 ° C of 0 kelvin). Dit is de theoretische laagst mogelijke temperatuur, waarbij alle moleculaire beweging stopt.
Samenvattend:
* Het is onmogelijk dat een gas in werkelijkheid nul volume heeft.
* De ideale gaswet voorspelt dat een gas met nul volume een temperatuur van absolute nul zou hebben.
* Het bereiken van absolute nul is in de praktijk ook onmogelijk.
Het is belangrijk om te onthouden dat de ideale gaswet een vereenvoudiging is en echte gassen gedragen zich niet altijd ideaal, vooral bij zeer lage temperaturen of hoge druk.
 Studie onthult wetenschap achter traditionele techniek voor het maken van mezcal
Studie onthult wetenschap achter traditionele techniek voor het maken van mezcal Hoe ionisch:Steigers zijn verantwoordelijk voor calciumcarbonaatkristallen
Hoe ionisch:Steigers zijn verantwoordelijk voor calciumcarbonaatkristallen  Wat is de staat van element in de natuurzwavel?
Wat is de staat van element in de natuurzwavel?  Onderzoek onthult waarom urine die door katten wordt gespoten een scherpe geur afgeeft
Onderzoek onthult waarom urine die door katten wordt gespoten een scherpe geur afgeeft  Welke vorm heeft het molecuul SiF4?
Welke vorm heeft het molecuul SiF4?
Hoofdlijnen
- Doel van pepsine in DNA -extract?
- Het officiële einde van alle enzymnamen?
- Verschil tussen triglyceriden en fosfolipiden
- Welk orgaansysteem is verantwoordelijk voor de productie van bloedcellen?
- Waarin is bijna alles in een levend organisme gemaakt?
- Wat zijn eogenese -telogenese en mesogenese?
- Hoe verhoogt onafhankelijke oriëntatie van chromosoom tijdens meiose de genetische variatie?
- Hoge genetische diversiteit ontdekt bij Zuid-Afrikaanse luipaarden
- Wat is een kalkhoudend skelet?
- Chemiluminescentiesondes voor de snelle en gevoelige detectie van salmonella en listeria
- Nieuw onderzoek optimaliseert zowel elasticiteit als stijfheid in hetzelfde materiaal zonder de gebruikelijke compromissen

- Samenstelling van wijnstokken in het regenwoud verhongert alvleesklierkankercellen
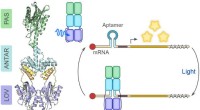
- Blauw licht voor RNA-controle
- Nieuwe materialen en processen om pathogene micro-organismen uit water te verwijderen
 Mangaan single-atom katalysator verhoogt de prestaties van elektrochemische kooldioxide-reductie
Mangaan single-atom katalysator verhoogt de prestaties van elektrochemische kooldioxide-reductie Wat zijn de drie manieren waarop een natie kan groeien?
Wat zijn de drie manieren waarop een natie kan groeien?  De atomaire dynamiek van zeldzame eeuwige elektrische velden
De atomaire dynamiek van zeldzame eeuwige elektrische velden Wat gebeurt er met de tijd dat het de planeten rond de baan van de planeten kost naarmate ze verder wegkomen?
Wat gebeurt er met de tijd dat het de planeten rond de baan van de planeten kost naarmate ze verder wegkomen?  Welke wetenschappelijke disciplines registreren de vormen en locaties van continenten?
Welke wetenschappelijke disciplines registreren de vormen en locaties van continenten?  Wat kunnen we leren door fossielen te bestuderen?
Wat kunnen we leren door fossielen te bestuderen?  Welk element is een radioactief alkalimetaal?
Welk element is een radioactief alkalimetaal?  Welk jaar landde het eerste ambacht op de maan?
Welk jaar landde het eerste ambacht op de maan?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

