
Wetenschap
Wat is de relatie tussen moleculaire massa en dampdichtheid?
dampdichtheid
* Dampdichtheid is de dichtheid van een gas of damp ten opzichte van de dichtheid van waterstofgas bij dezelfde temperatuur en druk.
* Het is in wezen een maat voor hoeveel zwaarder een gas wordt vergeleken met waterstof.
Moleculaire massa
* Moleculaire massa is de massa van één molecuul van een stof, meestal tot expressie gebracht in atomaire massa -eenheden (AMU).
De relatie
* dampdichtheid is ongeveer gelijk aan de helft van de moleculaire massa van het gas.
Deze relatie komt voort uit het feit dat:
* Waterstofgas (H₂) heeft een moleculaire massa van 2 AMU.
* Dampdichtheid is een verhouding van dichtheden en de dichtheid is recht evenredig met massa.
formule:
Dampdichtheid (Vd) ≈ (moleculaire massa (mm) / 2)
Voorbeeld:
* Zuurstofgas (O₂) heeft een moleculaire massa van 32 AMU.
* De dampdichtheid zou ongeveer 32/2 =16 zijn. Dit betekent dat zuurstofgas 16 keer zwaarder is dan waterstofgas.
Belangrijke opmerking:
De relatie is benaderd omdat dampdichtheid wordt beïnvloed door factoren zoals temperatuur en druk. Voor de meeste praktische doeleinden is de benadering echter geldig.
Samenvattend:
De dampdichtheid van een gas is recht evenredig met zijn moleculaire massa. Als u de ene waarde kent, kunt u de andere berekenen. Deze relatie is een waardevol hulpmiddel om de relatieve gewichten van gassen te begrijpen.
 Hoe 2D-materialen te vergroten als enkele kristallen
Hoe 2D-materialen te vergroten als enkele kristallen  Monitoring van COVID-19:kunnen medicijnen die in afvalwater worden aangetroffen een vroegtijdige waarschuwing geven?
Monitoring van COVID-19:kunnen medicijnen die in afvalwater worden aangetroffen een vroegtijdige waarschuwing geven?  Welk gas van het volgende zal de grootste afwijking hebben van ideaal gedrag H2 F2 BR2 en CL2?
Welk gas van het volgende zal de grootste afwijking hebben van ideaal gedrag H2 F2 BR2 en CL2?  Waarom ammoniak heeft een hoger kookpunt dan fosfine?
Waarom ammoniak heeft een hoger kookpunt dan fosfine?  Meest voorkomende atoom in het universum?
Meest voorkomende atoom in het universum?
 Verschillen tussen noord- en zuidflank
Verschillen tussen noord- en zuidflank Hoe een methaanwetenschapper de pauze van Biden over LNG-goedkeuringen beïnvloedde
Hoe een methaanwetenschapper de pauze van Biden over LNG-goedkeuringen beïnvloedde  NASA vangt orkaan Juliette boven het Socorro-eiland in Mexico
NASA vangt orkaan Juliette boven het Socorro-eiland in Mexico Volgens de weersvoorspelling zou het 90 graden zijn. Dus waarom zegt je thermometer dat het 100 is?
Volgens de weersvoorspelling zou het 90 graden zijn. Dus waarom zegt je thermometer dat het 100 is? Welke twee gebieden op aarde hebben seizoenen?
Welke twee gebieden op aarde hebben seizoenen?
Hoofdlijnen
- Ondergrondse schimmelinteracties met bomen helpen bij het verklaren van invasies van niet-inheemse planten
- Wordt de microvilli gevonden in een plant- of dierencel?
- Hoe relateer je de niveaus van orgaansystemen aan elkaar en het hele systeem of organisme?
- Hoe is cytokinese anders bij planten en dieren?
- Wie geeft er om WA-uilen?
- Heeft de gezondheidsstatus van de vader bij muggen invloed op de resultaten van de nakomelingen van de moeder?
- Wat is de ATP -rol bij cellulaire ademhaling?
- Een 3D-model voor celbiologische projecten bouwen Mitochondria en chloroplast
- Wat zijn de voordelen van eiwitexpressie en zuivering?
- Transparant keramisch pantser biedt superieure ballistische bescherming ten opzichte van traditionele glaslaminaten

- Nieuwe antibacteriële geneesmiddelen ontwikkeld aan de Universiteit van Oost-Finland
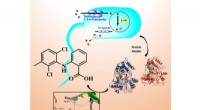
- Lichtgevoelig molecuul helpt zeedieren hun voortplantingscyclus te synchroniseren
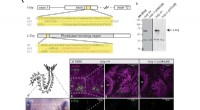
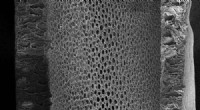
- Membranen voor het op industriële schaal scheiden van chemische mengsels
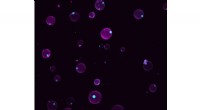
- Kunstmatige cellen reageren op veranderingen in de omgeving
 Hoe hoog strekt de atmosfeer zich uit vanaf de aarde?
Hoe hoog strekt de atmosfeer zich uit vanaf de aarde?  Wat is de volledige vorm van omgeving?
Wat is de volledige vorm van omgeving?  Fijiërs verteld om onderdak te zoeken als supercycloon nadert
Fijiërs verteld om onderdak te zoeken als supercycloon nadert Nieuw model suggereert verloren continenten voor de vroege aarde
Nieuw model suggereert verloren continenten voor de vroege aarde Onderzoekers bestuderen het suikeropnamemechanisme van industrieel micro-organisme
Onderzoekers bestuderen het suikeropnamemechanisme van industrieel micro-organisme Waarom hebben zuurstof en waterstof subscripts van 2?
Waarom hebben zuurstof en waterstof subscripts van 2?  err http://www.
err http://www. Hoe heeft Ptolemy het zonnestelsel ontdekt?
Hoe heeft Ptolemy het zonnestelsel ontdekt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

