
Wetenschap
Waarom groeien stoffen uit wanneer de temperatuur wordt verhoogd?
* Kinetische energie en moleculaire beweging: Moleculen in een stof zijn constant in beweging. Deze beweging wordt kinetische energie genoemd.
* Temperatuur en kinetische energie: Temperatuur is een maat voor de gemiddelde kinetische energie van de moleculen in een stof. Hogere temperatuur betekent dat de moleculen sneller bewegen.
* Verhoogde afstand: Naarmate de moleculen sneller bewegen, botsen ze vaker met elkaar en met een grotere kracht. Deze verhoogde botsingskracht duwt de moleculen verder uit elkaar, wat leidt tot een uitbreiding in de stof.
Denk er zo aan: Stel je een groep mensen voor in een drukke kamer. Als iedereen stilstaat, passen ze in een kleinere ruimte. Maar als iedereen snel begint te bewegen, hebben ze meer ruimte nodig om te voorkomen dat ze tegen elkaar botsen. Hetzelfde principe is van toepassing op moleculen in een stof.
Soorten uitbreiding:
* Lineaire uitbreiding: Dit verwijst naar de uitbreiding van een stof in één dimensie, zoals de lengte van een metalen staaf.
* Uitbreiding van gebiedsgebied: Dit verwijst naar de uitbreiding van een stof in twee dimensies, zoals het oppervlak van een plaat metaal.
* Volume -uitbreiding: Dit verwijst naar de uitbreiding van een stof in drie dimensies, zoals het volume van een container water.
Uitzonderingen:
Terwijl de meeste stoffen uitzetten wanneer ze worden verwarmd, zijn er enkele uitzonderingen, zoals water tussen 0 ° C en 4 ° C. In dit temperatuurbereik samentrekt water eigenlijk enigszins na verwarming. Dit ongebruikelijke gedrag is te wijten aan de unieke eigenschappen van watermoleculen en hun waterstofbinding.
Laat het me weten als je meer informatie wilt over een van deze aspecten!
 Monitoring van tussenproducten in CO2-conversie naar formiaat door metaalkatalysator
Monitoring van tussenproducten in CO2-conversie naar formiaat door metaalkatalysator Wat gebeurt er met de temperatuur van een vloeistof als deze van damp verandert?
Wat gebeurt er met de temperatuur van een vloeistof als deze van damp verandert?  Wat is de pH voor ammoniumchloride?
Wat is de pH voor ammoniumchloride?  Welke polaire en niet -molocules zijn?
Welke polaire en niet -molocules zijn?  Waarom lost water een alka -seltzer -tablet sneller op dan waterstofperoxide op?
Waarom lost water een alka -seltzer -tablet sneller op dan waterstofperoxide op?
 LSU Coast &Environment-klasse die een bevroren ijstijd modelleert
LSU Coast &Environment-klasse die een bevroren ijstijd modelleert Klimaatverandering:Amazon verandert mogelijk van vriend in vijand
Klimaatverandering:Amazon verandert mogelijk van vriend in vijand NASA laat zien hoe Harvey gebieden in Texas verzadigd heeft
NASA laat zien hoe Harvey gebieden in Texas verzadigd heeft Drone-tests vinden een aantal verhoogde verontreinigende stoffen in de legerfabriek
Drone-tests vinden een aantal verhoogde verontreinigende stoffen in de legerfabriek Hoe moeten planten en dieren zich aanpassen aan het leven op het land?
Hoe moeten planten en dieren zich aanpassen aan het leven op het land?
Hoofdlijnen
- Wat doet bliksem eigenlijk met een boom?
- Wat doen we nu met de stikstofademhaling?
- Wat zijn de 20 takken van wetenschap en hun definities?
- Wetenschappers ontwikkelen aardnoot die resistent is tegen aflatoxine
- Chimpansees in gevangenschap vertonen tekenen van een aangetaste geestelijke gezondheid
- Wordt DNA gebruikt om genetische aandoeningen te identificeren?
- Wat is een mutatie die de dood van een organisme veroorzaakt?
- Hoe het tijdperk van zoogdieren zou kunnen eindigen
- Wat is histonacetylatie?
- Nieuw covalent organisch raamwerk met boor en fosfor zorgt voor betere connectiviteit
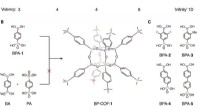
- Onderzoekers onderzoeken manieren om antibiotica te verwijderen die meren en rivieren vervuilen

- Trilling slechts in één richting

- Wetenschappers vinden lichtgewicht vloeibare metalen materialen uit

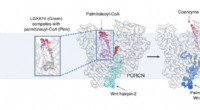
- Nieuwe cryo-EM-beelden werpen licht op Wnt-signalering
 Krijgen planten energie uit de grond?
Krijgen planten energie uit de grond?  Hoe wordt mitochondriale DNA MT -typen gebruikt in forensische wetenschap?
Hoe wordt mitochondriale DNA MT -typen gebruikt in forensische wetenschap?  Hoeveel gratis elektronen in semi-geleider?
Hoeveel gratis elektronen in semi-geleider?  Natuurkundigen meten fotonische interacties op atomair niveau
Natuurkundigen meten fotonische interacties op atomair niveau Op grafeen gebaseerde neurale sondes onderzoeken hersenactiviteit in hoge resolutie
Op grafeen gebaseerde neurale sondes onderzoeken hersenactiviteit in hoge resolutie In deel A zagen we dat de theoretische opbrengst aan aluminiumoxide 1,70 mol bedraagt. Bereken het percentage als het werkelijk 1,24 is.?
In deel A zagen we dat de theoretische opbrengst aan aluminiumoxide 1,70 mol bedraagt. Bereken het percentage als het werkelijk 1,24 is.?  Wat is het verschil tussen een endonuclease en exonuclease?
Wat is het verschil tussen een endonuclease en exonuclease?  Gentrificatie niet langer een binnenstedelijk fenomeen in Australische steden
Gentrificatie niet langer een binnenstedelijk fenomeen in Australische steden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

