
Wetenschap
Waarom heeft vloeistof geen duidelijke vorm maar volume?
* intermoleculaire krachten: Dit zijn de krachten van aantrekkingskracht tussen moleculen. In vloeistoffen zijn deze krachten zwakker dan in vaste stoffen, maar sterker dan in gassen.
* Vorm: De zwakke intermoleculaire krachten in vloeistoffen laten moleculen voorbij elkaar glijden. Dit betekent dat de vloeistof kan stromen en de vorm van zijn container kan aannemen.
* Volume: De moleculen in een vloeistof zijn relatief dicht bij elkaar, waardoor een vast volume ontstaat. Hoewel ze kunnen bewegen, kunnen ze niet veel comprimeren omdat ze al strak verpakt zijn.
Hier is een analogie:
Stel je voor dat een groep mensen dicht bij elkaar in een kamer staat. Als ze hand in hand vasthouden (sterkere intermoleculaire krachten), kunnen ze niet vrij bewegen en een rigide vorm behouden (als een vaste stof). Als ze gewoon in de buurt staan met wat ruimte tussen hen (zwakkere intermoleculaire krachten), kunnen ze zich verplaatsen en de vorm van de kamer aannemen (als een vloeistof). Hoewel ze zich kunnen verplaatsen, bezetten ze echter nog steeds een bepaalde hoeveelheid ruimte (zoals een vast volume).
Samenvattend:
* vloeistoffen hebben geen duidelijke vorm omdat hun moleculen vrij kunnen bewegen, waardoor ze de vorm van hun container kunnen aannemen.
* vloeistoffen hebben een duidelijk volume omdat hun moleculen strak zijn verpakt en niet aanzienlijk kunnen worden gecomprimeerd.
 Wat wordt gemaakt als 2 atomen combineren?
Wat wordt gemaakt als 2 atomen combineren?  Observatie tijdens de reactie van strontium en zuurstof?
Observatie tijdens de reactie van strontium en zuurstof?  Een chemische reactie heeft een positieve H -waarde en S onder welke omstandigheden is de spontaan?
Een chemische reactie heeft een positieve H -waarde en S onder welke omstandigheden is de spontaan?  Hoe is het koken van ei een chemische verandering?
Hoe is het koken van ei een chemische verandering?  Forensisch chemicus stelt zweetteststrip voor als vervanging voor ademanalyse
Forensisch chemicus stelt zweetteststrip voor als vervanging voor ademanalyse
 Feiten over de wandelstok Bug
Feiten over de wandelstok Bug Mythbusting:vijf veelvoorkomende misvattingen over de milieueffecten van plastic voor eenmalig gebruik
Mythbusting:vijf veelvoorkomende misvattingen over de milieueffecten van plastic voor eenmalig gebruik Waar zou je in vredesnaam de grootste verscheidenheid aan soorten vinden?
Waar zou je in vredesnaam de grootste verscheidenheid aan soorten vinden?  Mysterieziekte verspreidt zich, bedreigt koraalriffen in Lower Florida Keys
Mysterieziekte verspreidt zich, bedreigt koraalriffen in Lower Florida Keys Een presentatie starten op Fast Food
Een presentatie starten op Fast Food
Hoofdlijnen
- Hebben alle cellen dezelfde samenstelling?
- Afrikaanse slaapziekte:hoe de ziekteverwekker tseetseevliegen koloniseert
- Nieuwe mechanismen beschrijven hoe het genoom zichzelf reguleert
- Wat is een belangrijk kenmerk van de wetenschappelijke methode?
- Hoe maak je een werkend hart Model
- Hoe een interne lichaamsklok spoelwormen vrijhoudt van constipatie
- Reproductieve cellen hebben 23 chromosomen. Welke term beschrijft deze structuur?
- Wat gebeurt er als een eigenschap codominante allelen toont?
- Wat voor soort wetenschapper bestudeert vervuiling?
- Vlakke en gebogen pyrrool-gefuseerde azacoronenen

- Team ontwikkelt machine met als doel een einde te maken aan textielverspilling

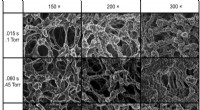
- Marcus-regime in organische apparaten - grensvlakladingsoverdrachtsmechanisme geverifieerd
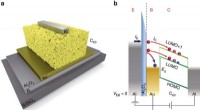
- Onderzoekers rapporteren tweezijdige Janus-membraantoepassingen
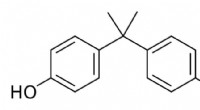
- Wat is BPA en waarom zit het in zoveel plastic producten?
 Wat is de energieverandering in draaiende spiraal?
Wat is de energieverandering in draaiende spiraal?  Opwarming van de aarde om gewelddadige misdaad in de Verenigde Staten te vergroten
Opwarming van de aarde om gewelddadige misdaad in de Verenigde Staten te vergroten Wat zijn de vleugtespieren van het menselijk lichaam?
Wat zijn de vleugtespieren van het menselijk lichaam?  Hoe het Amerikaanse abortusbeleid vrouwen in Afrika beïnvloedt
Hoe het Amerikaanse abortusbeleid vrouwen in Afrika beïnvloedt  Hoe Algebra te leren De gemakkelijke manier
Hoe Algebra te leren De gemakkelijke manier  Als we weten dat het totaal in een systeem 30 joules en poteial energie 20jolues is wat KE?
Als we weten dat het totaal in een systeem 30 joules en poteial energie 20jolues is wat KE?  Waar waar en hoe heeft orkaan Katrina plaatsgevonden?
Waar waar en hoe heeft orkaan Katrina plaatsgevonden?  In het laboratorium gekweekt vlees zou over 3 jaar in restaurants kunnen liggen (update)
In het laboratorium gekweekt vlees zou over 3 jaar in restaurants kunnen liggen (update)
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

