Wetenschap
Hoe een interne lichaamsklok spoelwormen vrijhoudt van constipatie
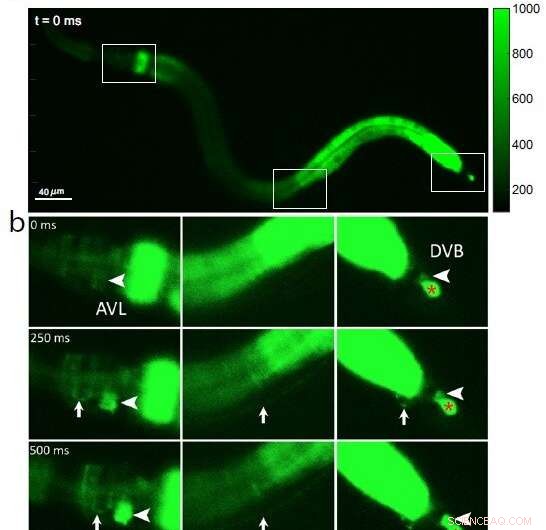
Fig 1:Calciumfluorescentiebeelden van een hele C. elegans-worm, met (a) drie omkaderde secties van belang van kop tot staart (van links naar rechts) op tijdstip 0 vóór activering van zenuwcellen; (b) een initiële calciumgolf in de darm wordt gevolgd door activering van het zenuwcellichaam AVL in het hoofd (grote pijlpunt, linkerpaneel), AVL-zenuwvezel (kleine pijl, linker- en middelste panelen), preanale zenuw-spierovergang (klein pijl, rechterpaneel) en zenuwcellichaam DVB in de staart (grote pijlpunt, rechterpaneel). Als referentie voor een negatieve controle toont de rode * in het rechterpaneel een niet-aangetaste cel die niet relevant is voor de ontlastingscyclus. Credit:Jiang, J. et al, Nature Communications (2022). DOI:10.1038/s41467-022-30452-y
Een team onder leiding van een neurowetenschapper van de City University of Hong Kong (CityU) heeft een sleutelmechanisme geïdentificeerd van een biologische klok die ervoor zorgt dat rondwormen regelmatig blijven door met regelmatige tussenpozen te poepen.
De ontlastingsstap staat onder de getimede controle van een zenuwcel in de kop van de worm. Deze cel geeft ongeveer elke 45 seconden een zenuwimpuls of elektrische ontlading af. Elke impuls wordt onmiddellijk langs de worm overgedragen via een zenuwvezel die contact maakt met een zenuwcel in de staart. Deze cel vuurt vervolgens een impuls af met de bijna gesynchroniseerde impuls van de hoofdzenuwcel die de onderste darmspieren stimuleert om ontlasting te verdrijven.
"De 1 millimeter lange rondworm Caenorhabditis elegans, of C. elegans, wordt door levenswetenschappers over de hele wereld als modelorganisme gebruikt. Als wildtype wormen in de buurt zijn van voldoende voedsel, eten ze constant zonder te stoppen, maar poep elke 45 seconden met bijna klokachtige precisie. Waarom en hoe wormen dat doen, heeft onderzoekers ertoe aangezet om de onderliggende mechanismen te bestuderen, "zegt teamleider Dr. Liu Qiang, universitair docent bij de CityU-afdeling Neurowetenschappen. "Onze bevindingen lossen dit 30-jarige mysterie op en verdiepen ons begrip van het genereren van ritmisch gedrag, evenals de verbindingen tussen het zenuwstelsel van een dier en de fysiologie."
Het onderzoek werd gezamenlijk begeleid door Dr. Liu Qiang van CityU en Dr. Louis Tao van Peking University. De resultaten zijn op 19 mei 2022 gepubliceerd in Nature Communications , onder de titel "C. elegans enterische motorneuronen vuren gesynchroniseerde actiepotentialen die ten grondslag liggen aan het motorische ontlastingsprogramma."
Darm-hersencircuit
C. elegans is goed bestudeerd in neurowetenschappen en hersenonderzoek, en alle 302 cellen van zijn zenuwstelsel zijn geïdentificeerd, benoemd en fysiek in kaart gebracht, samen met al hun zenuwverbindingen. De twee belangrijke zenuwcellen die betrokken zijn bij het reguleren van de stoelgang zijn AVL in het hoofd en DVB in de staart.
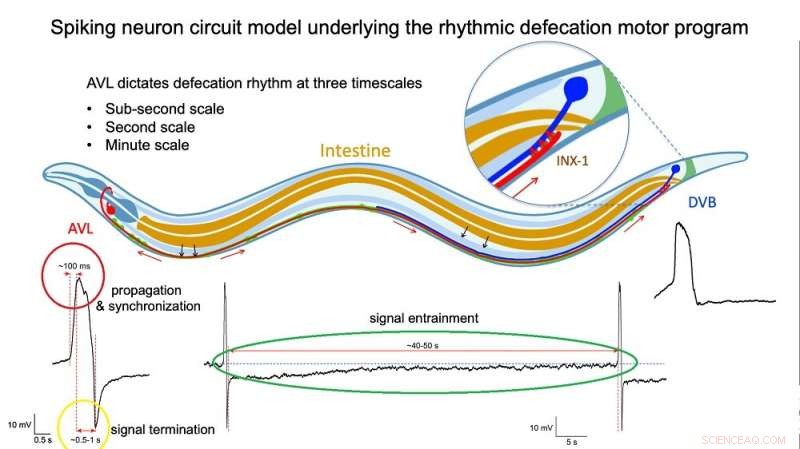
Fig 2:Illustratie van het spiking-neuroncircuitmodel dat ten grondslag ligt aan het ritmische defecatiegedrag. Credit:Dr. Liu Qiang/ City University of Hong Kong
"Onderzoekers wisten dat de darm van C. elegans een periodieke toename van calcium, calciumgolven genaamd, in de epitheelcellen genereert, die de afgifte van darmneuropeptiden veroorzaken die AVL- en DVB-zenuwcellen stimuleren, wat leidt tot ontlasting. De onderliggende mechanismen van communicatie tussen de darm en de hersenen waren onbekend. Hoe de twee enterische neuronen, één in de kop van de worm, de andere in de staart, met elkaar communiceren over zo'n lange afstand terwijl ze het timingsignaal dat van de darm werd ontvangen met opmerkelijke robuustheid en nauwkeurigheid verwerken?' zegt dr. Liu. "Voor de eerste keer hebben we aangetoond dat AVL- en DVB-zenuwcellen alles-of-niets spiked-impulsen of actiepotentialen produceren, en deze digitale signalering stelt AVL in het hoofd in staat om directe langeafstandscommunicatie uit te voeren met DVB in de staart om reguleren uitwerpselen."
Omdat calciumionen tijdens elke zenuwimpuls de cel binnenstormen, onderzochten de onderzoekers AVL-naar-DVB-signalering door een speciale microscoop te gebruiken om wormen te filmen die waren geprogrammeerd om fluorescerend groen te gloeien in de aanwezigheid van calcium. Ze zagen voor het eerst een algemene golf van calcium door de darmen. Na ongeveer 3 seconden ontdekten ze bijna gelijktijdige calciumpieken in AVL en DVB die een halve seconde duurden en ongeveer eens per 45 seconden terugkeerden (zie figuur 1).
De calciumpieken in AVL en DVB vielen samen met spierbewegingen van kop tot staart die plaatsvonden op bijna hetzelfde moment als de uitwerpselen van de ontlasting. Uit deze bevindingen concluderen de onderzoekers dat hoewel de darm zelf de algemene defecatie-pacemaker is, gesynchroniseerde AVL- en DVB-impulsen de precieze timing en coördinatie regelen van kop-staartbewegingen van lichaam en darmen die nodig zijn voor de uitdrijvingsstap.
Multitasking-actiepotentiaal
Directe metingen van de spanning over het membraan van geïsoleerde AVL- en DVB-cellen bevestigden de puntige profielen van hun actiepotentialen. Nader onderzoek wees uit dat de AVL-impuls een ongebruikelijke actiepotentiaal is die bestaat uit twee dicht bij elkaar gelegen pieken. The first spike acts as a positive and rapid signal (signal rise in around 100 milliseconds, red circle in Figure 2) that propagates to DVB quickly (in milliseconds) and switches on the sequence of muscle motions leading to a bowel movement. The second spike acts as a negative and slower signal (in seconds, yellow circle in Figure 2) that switches off the sequence to inhibit further bowel movements and thus prevent excessive excretion. Furthermore, each AVL impulse is also followed by a long-lasting negative undershoot phase (in dozens of seconds, green circle in Figure 2) that inhibits DVB misfiring impulses when it is not supposed to.
"The AVL nerve cell in the head plays the most crucial role in regulating the defecation rhythm at multiple time scales," says Dr. Liu. "It not only relays but also modulates the pacemaker signal from the gut by resetting the system during each defecation cycle and preventing nerve misfiring between cycles, so that the body clock is kept robust and accurate."
This study paves the way for further research into gut–brain communication and other body clock systems underlying repetitive animal behaviors. "I have no doubt that fundamental principles of brain function learned from studying worms will be used as a springboard to gain understanding of more complex brains like ours," adds Dr. Liu.
 Wat is carbonaatbuffering?
Wat is carbonaatbuffering?
Veel van de meest herkenbare delen van de natuur functioneren door een of andere balans te handhaven. Het carbonaatbuffersysteem is een van de belangrijkste buffersystemen in de natuur, wat helpt om dat evenwicht te handh
 De fijne kneepjes van de stikstofcyclus onderzoeken
De fijne kneepjes van de stikstofcyclus onderzoeken Een venster voor traploos ladingtransport in organische halfgeleiders
Een venster voor traploos ladingtransport in organische halfgeleiders Niet zo snel:sommige batterijen kunnen te ver worden geduwd
Niet zo snel:sommige batterijen kunnen te ver worden geduwd Nanoporeuze materiaalnetten verontreinigende stoffen uit water
Nanoporeuze materiaalnetten verontreinigende stoffen uit water
 Warm ijs kan anders breken dan koud ijs
Warm ijs kan anders breken dan koud ijs Nieuw model helpt seizoensvariaties in stedelijke hitte-eilanden te verklaren
Nieuw model helpt seizoensvariaties in stedelijke hitte-eilanden te verklaren Paleoklimatoloog onthult oude klimaatfeedbacklus die de effecten van de laatste opwarming van de aarde versnelde
Paleoklimatoloog onthult oude klimaatfeedbacklus die de effecten van de laatste opwarming van de aarde versnelde Restspanning ondanks mega aardbeving
Restspanning ondanks mega aardbeving Satellieten brengen koolstof in kaart die is vastgelegd door bossen, met een nauwkeurigheid tot tien meter
Satellieten brengen koolstof in kaart die is vastgelegd door bossen, met een nauwkeurigheid tot tien meter
Hoofdlijnen
- De isovormen van het HP1-eiwit reguleren de organisatie en structuur van heterochromatine
- Doden lindebomen bijen?
- Planten kunnen de intensiteit van zoutstress meten
- Aussie uilen vallen door rattengif
- Hoe ballistische valkaakmieren zelfvernietiging voorkomen met een perfecte onderkaakboog
- Hoe klimaatverandering subalpiene wilde bloemengemeenschappen kan hervormen
- Eenvoudige manieren om de structuren van de Skull
- Hoe de circadiane cyclus de reactie op medicijnen in planten beïnvloedt
- Sterke gastheren helpen parasieten zich verder te verspreiden
 Hoe kun je zien of een stof zuur is?
Hoe kun je zien of een stof zuur is?  Ons voedselsysteem transformeren om een duurzame toekomst te garanderen
Ons voedselsysteem transformeren om een duurzame toekomst te garanderen Amerikaanse schatkist, luchtvaartmaatschappijen bereiken akkoord over financiële hulp
Amerikaanse schatkist, luchtvaartmaatschappijen bereiken akkoord over financiële hulp Een biologische oplossing voor het afvangen en recyclen van koolstof?
Een biologische oplossing voor het afvangen en recyclen van koolstof? Hoe MG naar MMOL /L
Hoe MG naar MMOL /L  Het snel bevolkte kustgebied van de Golf tot Pakistan wordt geconfronteerd met een enorm tsunami-risico
Het snel bevolkte kustgebied van de Golf tot Pakistan wordt geconfronteerd met een enorm tsunami-risico Wat gebeurt er met het tekort aan halfgeleiderchips?
Wat gebeurt er met het tekort aan halfgeleiderchips? Verbetering van de detectie van antilichamen tegen het Afrikaanse varkenspestvirus in serum
Verbetering van de detectie van antilichamen tegen het Afrikaanse varkenspestvirus in serum
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com