
Wetenschap
Welke massa natriumbenzoaat moet worden toegevoegd aan 160,0 ml A 0,15 benzoëzuuroplossing om buffer te krijgen met pH 4.30?
1. Begrijp de chemie
* benzoëzuur (c₆h₅cooh) is een zwak zuur.
* Natriumbenzoate (C₆h₅coona) is het zout van zijn geconjugeerde basis.
* Wanneer u een zwak zuur en de conjugaatbasis mengt, maakt u een bufferoplossing.
2. De Henderson-Hasselbalch-vergelijking
De Henderson-Hasselbalch-vergelijking relateert de pH van een buffer tot de PKA van het zwakke zuur en de verhouding van de concentraties van de conjugaatbasis en zwak zuur:
pH =pKa + log ([conjugaatbasis] / [zwak zuur]))
3. Informatie gegeven
* pH: 4.30
* Volume van benzoëzuuroplossing: 160,0 ml
* concentratie van benzoëzuuroplossing: 0,15 m
* PKA van benzoëzuur: 4.20 (u moet dit waarschijnlijk opzoeken of krijgen)
4. Bereken de verhouding van conjugaatbasis tot zwak zuur
* Herschik de Henderson-Hasselbalch-vergelijking om op te lossen voor de verhouding:
[conjugaatbasis] / [zwak zuur] =10^(pH - pKa)
* Sluit de waarden aan:
[conjugaatbasis] / [zwak zuur] =10^(4.30 - 4.20) =1.0
5. Bereken de mol benzoëzuur
* Moles =concentratie × Volume (in liters)
* Mol benzoëzuur =0,15 m x 0,160 l =0,024 mol
6. Bereken de mol natriumbenzoaat die nodig is
* Aangezien de verhouding van [conjugaatbasis] / [zwak zuur] 1,0 is, hebben we een gelijk aantal mol natriumbenzoaat nodig als benzoëzuur:
* Mol natriumbenzoaat =0,024 mol
7. Bereken de massa natriumbenzoaat
* Massa =mollen × molaire massa
* Molaire massa natriumbenzoaat (c₆h₅coona) =144,11 g/mol
* Massa van natriumbenzoaat =0,024 mol × 144,11 g/mol = 3,46 g
Daarom moet u ongeveer 3,46 gram natriumbenzoaat toevoegen aan de benzoëzuuroplossing om een buffer met een pH van 4.30 te maken.
 Wat is de kleur van waterstofbromide?
Wat is de kleur van waterstofbromide?  Wat zijn de chemicaliën die vroeger niet -biologisch afbreekbaar plastic afbreekbaar plastic omzetten?
Wat zijn de chemicaliën die vroeger niet -biologisch afbreekbaar plastic afbreekbaar plastic omzetten?  Als één chlooratoom zich in de aanwezigheid van lithium en natrium bevindt, waarmee zal het zich dan binden?
Als één chlooratoom zich in de aanwezigheid van lithium en natrium bevindt, waarmee zal het zich dan binden?  Voorbeelden van hoe Density werkt
Voorbeelden van hoe Density werkt Hoeveel zout kan ik oplossen in een liter water?
Hoeveel zout kan ik oplossen in een liter water?
 Wat zijn enkele manieren waarop menselijke geografie ons leven kan beïnvloeden?
Wat zijn enkele manieren waarop menselijke geografie ons leven kan beïnvloeden?  De opwarming van het noordpoolgebied zorgt voor een brede verandering in de omgeving:studie
De opwarming van het noordpoolgebied zorgt voor een brede verandering in de omgeving:studie China's oorlog tegen vervuiling laat veelbelovende resultaten zien, studie vondsten
China's oorlog tegen vervuiling laat veelbelovende resultaten zien, studie vondsten Aardwetenschappen, wat is tot?
Aardwetenschappen, wat is tot?  Video:Satellietgegevens bewaren
Video:Satellietgegevens bewaren
Hoofdlijnen
- Eén enkele haar laat onderzoekers zien wat een beer heeft gegeten
- Simulatie laat zien hoe transporteiwitten hun werk doen in cellen
- Is een virus kleiner dan een organel?
- Wat is een niet-voorbeeld van lysosoom?
- Zullen we binnenkort uitgestorven zijn?
- Wetenschappers herstellen ingestorte mosselpopulatie en waterkwaliteit in Shinnecock Bay
- Hoe celconcentratie te berekenen
- Ondergewaardeerde microben krijgen nu de eer voor het behouden van twee banen in de bodem
- Wildlife betaalt de prijs van illegale begrazing in Kenia
- Overlevingsstrategie:hoe één enzym bacteriën helpt herstellen van blootstelling aan antibiotica

- Spinout wil het testen van voedselveiligheid transformeren

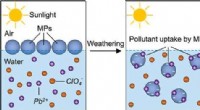
- Onderzoekers onderzoeken milieuverwering van microplastics, opname van verontreinigende stoffen
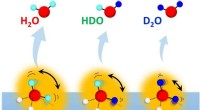
- De impact van moleculaire rotatie op een eigenaardig isotoopeffect op waterstofbruggen in water
- Zijdevezels kunnen hightech natuurlijke metamaterialen zijn

 Chiraal nulgeluid gevonden in Weyl-halfmetalen
Chiraal nulgeluid gevonden in Weyl-halfmetalen Het effect van golflengte op fotovoltaïsche cellen
Het effect van golflengte op fotovoltaïsche cellen  Perovskiet-zonnecellen getest op prestaties in de echte wereld - in het laboratorium
Perovskiet-zonnecellen getest op prestaties in de echte wereld - in het laboratorium Waarom moet u veiligheidsschermen gebruiken in een wetenschappelijk lab?
Waarom moet u veiligheidsschermen gebruiken in een wetenschappelijk lab?  Hoe werken vrachtwagenweegstations?
Hoe werken vrachtwagenweegstations?  Hoeveel gram in één ml?
Hoeveel gram in één ml?  NASA heeft net een sonde op Mars geland - hier is waarom zijn er
NASA heeft net een sonde op Mars geland - hier is waarom zijn er Wat is de hoogste snelheid ooit bereikt door een raket?
Wat is de hoogste snelheid ooit bereikt door een raket?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

