
Wetenschap
Een katalysator verhoogt de snelheid van een chemische reactie door te veranderen welke de volgende omstandigheden?
Dit is waarom:
* Activeringsenergie: Dit is de minimale hoeveelheid energie die nodig is om moleculen te reageren. Zie het als de "bult" die een molecuul moet klimmen om een product te worden.
* de rol van Catalyst: Een katalysator biedt een alternatieve reactieroute met een lagere activeringsenergie. Dit betekent dat de moleculen minder energie nodig hebben om te reageren, wat leidt tot een snellere reactiesnelheid.
Sleutelpunten:
* Katalysatoren worden niet geconsumeerd in de reactie. Ze faciliteren eenvoudig de reactie.
* Katalysatoren veranderen de evenwichtspositie van een reactie niet. Ze versnellen alleen de snelheid waarmee evenwicht wordt bereikt.
Laat het me weten als je meer details wilt over hoe katalysatoren werken!
 Ongeziene reizigers:stofstormen kunnen bacteriën en schimmels over de hele wereld verspreiden
Ongeziene reizigers:stofstormen kunnen bacteriën en schimmels over de hele wereld verspreiden  Ontbossing in Cambodja gekoppeld aan hoger risico op slechte gezondheid bij jonge kinderen
Ontbossing in Cambodja gekoppeld aan hoger risico op slechte gezondheid bij jonge kinderen Dispergeermiddelen verbeterden de luchtkwaliteit voor hulpverleners bij Deepwater Horizon
Dispergeermiddelen verbeterden de luchtkwaliteit voor hulpverleners bij Deepwater Horizon Wat is de doelstellingen die bestuderen van de meteorologie en klimatologie van de landbouw?
Wat is de doelstellingen die bestuderen van de meteorologie en klimatologie van de landbouw?  Fossiele aardbevingen bieden nieuw inzicht in seismische activiteit diep onder het aardoppervlak
Fossiele aardbevingen bieden nieuw inzicht in seismische activiteit diep onder het aardoppervlak
Hoofdlijnen
- VS voorstel zou het doden van adelaars toestaan naarmate hernieuwbare energiebronnen toenemen
- Biologen werpen licht op hoe cellen hulpbronnen verplaatsen
- Uit onderzoek blijkt hoe lysozymeiwit in tranen gevaarlijke bacteriën vernietigt
- Een ellebooggewricht bouwen Model
- Waarom leggen boomkikkers hun eieren op de grond?
- Waarom katten meer naar mensen miauwen dan naar elkaar
- Onderzoek naar de lysosomale biologie:huidige benaderingen en methoden
- Welke celorganel wordt geassocieerd met inname?
- Welke soorten plantencellen zijn er?
- Anionen en kationen in dual-ionbatterijen werken als koeherders- en weversmeisjes

- Activering met zichtbaar licht maakt transformatie van stabiele sulfonen naar waardevolle glycosiden mogelijk
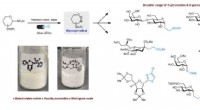
- Wetenschappers bouwen M29-clustermodelkatalysator
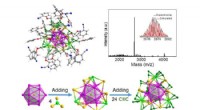
- Zeewaterbacteriën bieden aanknopingspunten om melanoom te bestrijden
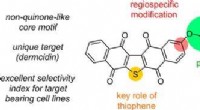
- Protocell-gasten ontvluchten het nest

 De Black Lives Matter-protesten motiveerden mensen om in 2016 te gaan stemmen. Zullen de protesten dit jaar hetzelfde doen?
De Black Lives Matter-protesten motiveerden mensen om in 2016 te gaan stemmen. Zullen de protesten dit jaar hetzelfde doen? Wat betekent het als cellen gespecialiseerd zijn in meercellige organismen?
Wat betekent het als cellen gespecialiseerd zijn in meercellige organismen?  Wat gebeurt er in de reactie tussen salicylzuur en natriumhydroxide?
Wat gebeurt er in de reactie tussen salicylzuur en natriumhydroxide?  Minder werkstress voor werknemers bij financieel transparante bedrijven
Minder werkstress voor werknemers bij financieel transparante bedrijven Geothermische HVAC-systemen verbeteren met wiskunde
Geothermische HVAC-systemen verbeteren met wiskunde Wat is het meest energieniveau van een atoom?
Wat is het meest energieniveau van een atoom?  Het proces waardoor sommige moleculaire verbindingen oplosen in water om ionen te vormen, is?
Het proces waardoor sommige moleculaire verbindingen oplosen in water om ionen te vormen, is?  Onderzoeken hoe korstmossen zichzelf verdedigen tegen giftige metalen en hoge zuurgraad
Onderzoeken hoe korstmossen zichzelf verdedigen tegen giftige metalen en hoge zuurgraad
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

