
Wetenschap
Een monster van een verbinding bevat 1,52 g stikstof en 3,47 zuurstof. De molaire massa Dit is tussen 90 gram 95 gram. Bepaal de moleculaire formule de nauwkeurige massa?
1. Bepaal de empirische formule
* Converteer grams in mollen:
- Mol stikstof (N):1,52 g / 14,01 g / mol =0,108 mol
- Mol zuurstof (O):3,47 g / 16,00 g / mol =0,217 mol
* Zoek de eenvoudigste verhouding tussen het hele nummer: Verdeel beide molwaarden door de kleinere (0,108 mol):
- n:0,108 mol / 0,108 mol =1
- O:0,217 mol / 0,108 mol ≈ 2
* De empirische formule is no₂
2. Bepaal de moleculaire formule
* Bereken de empirische formulemassa:
- No₂:(14.01 g/mol) + 2 (16,00 g/mol) =46.01 g/mol
* Vind het hele nummer meerdere:
- Verdeel het gegeven molaire massa-bereik (90-95 g/mol) door de empirische formulemassa:
- 90 g/mol/46.01 g/mol ≈ 1,96
- 95 g/mol/46.01 g/mol ≈ 2.06
- Het hele nummer meerdere is waarschijnlijk 2.
* Vermenigvuldig de empirische formulesubscripts met 2:
- De moleculaire formule is n₂o₄
3. Bepaal de nauwkeurige massa
* Bereken de molaire massa van N₂o₄:
- 2 (14.01 g/mol) + 4 (16,00 g/mol) = 92.02 g/mol
Daarom is de moleculaire formule van de verbinding N₂o₄ en de nauwkeurige massa is 92,02 g/mol.
 Wat is het type verwering waar rots opgelost door een zuur?
Wat is het type verwering waar rots opgelost door een zuur?  Chroom vormt twee bromiden, één met een gewichtspercentage van 17,82 procent chroom en nog eens 24,55 procent chroom. In het eerste monster per 1 gram bromide?
Chroom vormt twee bromiden, één met een gewichtspercentage van 17,82 procent chroom en nog eens 24,55 procent chroom. In het eerste monster per 1 gram bromide?  Wat doet bevriezing met tonisch water?
Wat doet bevriezing met tonisch water?  Wat zijn de overeenkomsten in het moderne periodiek systeem en de tabel?
Wat zijn de overeenkomsten in het moderne periodiek systeem en de tabel?  Video:Hoe meten we temperatuur?
Video:Hoe meten we temperatuur?
 China worstelt met onzekere gasvoorraden, maar blijft sterk in langetermijnplan voor hernieuwbare energie
China worstelt met onzekere gasvoorraden, maar blijft sterk in langetermijnplan voor hernieuwbare energie Satelliet ziet tropische cycloon Titli aan land komen in Noordoost-India
Satelliet ziet tropische cycloon Titli aan land komen in Noordoost-India Japan markeert tsunami, nucleaire tragedie acht jaar later
Japan markeert tsunami, nucleaire tragedie acht jaar later Naar een meer gelokaliseerd, impactgebaseerd waarschuwingssysteem voor extreem weer om hittegolven te verminderen
Naar een meer gelokaliseerd, impactgebaseerd waarschuwingssysteem voor extreem weer om hittegolven te verminderen Koolstof- en stikstofcycli interageren met vegetatieverschuivingen
Koolstof- en stikstofcycli interageren met vegetatieverschuivingen
Hoofdlijnen
- Wat zijn groepen organen die samenwerken om een bepaalde baan in het lichaam te verrichten?
- Nieuwe gegevens tonen de verspreiding van parasitaire hertenvliegen door de VS aan.
- Diagram om de relatie tussen cellen en volledig organisme te tonen?
- Welke conclusies kunt u trekken over de pH in cellen van het menselijk lichaam?
- Wat is het doel van het analyseren van gegevens die tijdens een experiment zijn verzameld?
- Ontdekken hoe cellen gaten dichten (met video)
- Vissenseks zo luid dat dolfijnen doof kunnen worden
- Experts:broederij in Idaho die is gebouwd om zalm te redden doodt ze
- Waarom wordt gramkleuring meestal niet toegepast op eukaryoten?
- Nieuw record:3D-geprinte optisch-elektronische integratie
- Harde magnetische coatings voor zeer nauwkeurige microscopie

- Chemische kariatiden verbeteren de stabiliteit van metaal-organische raamwerken
- Microglia in hersenweefsel visualiseren met een fluorescentie-aanzetsubstraat
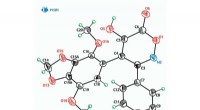
- Chemici vereenvoudigen de synthese van antitumorverbindingen
 Hoe Joule naar Mol
Hoe Joule naar Mol  Waarom ik mijn baan opzegde om geluk te onderzoeken en begon te fietsen naar Bhutan
Waarom ik mijn baan opzegde om geluk te onderzoeken en begon te fietsen naar Bhutan De winter is een belangrijke motor voor de uitstoot van lachgas uit boreale meren
De winter is een belangrijke motor voor de uitstoot van lachgas uit boreale meren Toekomstige CO2-begraafplaats Noorwegen krijgt vorm
Toekomstige CO2-begraafplaats Noorwegen krijgt vorm Hoe beïnvloedt amplitude de luidheid van een geluid?
Hoe beïnvloedt amplitude de luidheid van een geluid?  Niet alle diamanten zijn voor altijd:onderzoekers zien nanodiamanten die in steenkool zijn gemaakt binnen enkele seconden vervagen
Niet alle diamanten zijn voor altijd:onderzoekers zien nanodiamanten die in steenkool zijn gemaakt binnen enkele seconden vervagen Welke vier vormen van energie zijn bezeten door een vallende vrucht?
Welke vier vormen van energie zijn bezeten door een vallende vrucht?  Hoe een app eenzaamheid bij oude mensen met Kerstmis kan helpen bestrijden
Hoe een app eenzaamheid bij oude mensen met Kerstmis kan helpen bestrijden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

