
Wetenschap
Wat is de moleculaire geometrie van bromine pentafluoride?
Dit is waarom:
* centraal atoom: Bromine (BR) is het centrale atoom.
* valentie -elektronen: Bromine heeft 7 valentie -elektronen en elk fluor (F) atoom heeft 7 valentie -elektronen.
* Totale valentie -elektronen: 7 (Br) + 5 * 7 (f) =42 elektronen.
* elektronenparen: 42 elektronen / 2 elektronen per binding =21 elektronenparen.
* bindparen: 5 BR-F-obligaties =5 bindingsparen.
* eenzame paren: 21 totale paren - 5 bindingsparen =16 eenzame paren. Omdat we ons echter op het centrale atoom concentreren, beschouwen we alleen de enige paren. Bromine heeft één eenzaam paar.
De VSEPR -theorie (afstoting van de elektronenpaar van de valentieschaal) helpt ons de vorm te voorspellen:
* Het centrale broomatoom heeft 5 bindingsparen en één eenzaam paar, wat resulteert in een totaal van 6 elektronendomeinen.
* Gebaseerd op de VSEPR -theorie, leiden 6 elektronendomeinen rond een centraal atoom naar een octaëdrische elektronengeometrie.
* Het enige paar neemt meer ruimte in beslag dan de bindingsparen en vervormt de ideale octaëdrische geometrie. Dit duwt de vijf fluoratomen in een vierkante piramidale vorm.
Daarom is de moleculaire geometrie van bromine pentafluoride vierkante piramidale .
 Een groenblijvende boom die klinkt als ooi?
Een groenblijvende boom die klinkt als ooi?  Afbraak van polystyreen in de oceaan - vervuiling op wereldschaal
Afbraak van polystyreen in de oceaan - vervuiling op wereldschaal Het aanbrengen van steenstof op akkerlanden kan tot 2 miljard ton CO2 uit de atmosfeer opnemen
Het aanbrengen van steenstof op akkerlanden kan tot 2 miljard ton CO2 uit de atmosfeer opnemen De impact van gemeentelijke irrigatiesystemen op door aardbevingen veroorzaakte aardverschuivingen in Indonesië
De impact van gemeentelijke irrigatiesystemen op door aardbevingen veroorzaakte aardverschuivingen in Indonesië Brand in Notre Dame maakt de wereld wakker voor de gevaren van loodstof
Brand in Notre Dame maakt de wereld wakker voor de gevaren van loodstof
Hoofdlijnen
- Wat is beschrijvingonderzoek?
- Wat is een dunne laag vet die de cel omringt?
- Genetisch hulpmiddel dat een soort onder VN-beoordeling kan veroordelen
- Wat is de beste definitie van het woord pathogeen?
- Is de volgende vraag waar of onwaar classificeren, maakt het gemakkelijker om organismen te vergelijken en te contrasteren hun actiesgedragfuncties?
- De willekeurige verdeling van homologe chromosomen tijdens meiose wordt genoemd?
- Hoeveel vellen papier kunnen uit één enkele boom worden geproduceerd?
- DNA-reparatie na CRISPR-snijden helemaal niet wat mensen dachten
- Wat is de naam van de twee individuele strengen elk chromosoom?
- Moleculaire oriëntatie onderzoeken door polarisatie-selectieve transiënte absorptiespectroscopie
- Ontwikkeling van een 3D-deeltjesmodel voor afzonderlijke deeltjes in batterij-elektroden
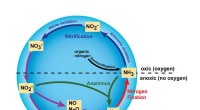
- De fijne kneepjes van de stikstofcyclus onderzoeken
- Wetenschappers ontdekken nieuwe niet-kleverige gels

- De spanning van een cel meten met een molecuul
 Hoeveel mol NaOH zijn er nodig om 2 liter een 2,0 M oplossing te bereiden?
Hoeveel mol NaOH zijn er nodig om 2 liter een 2,0 M oplossing te bereiden?  Hoe maak je een zelfgemaakte onderzeeër die drijft & zinkt
Hoe maak je een zelfgemaakte onderzeeër die drijft & zinkt  Waarom werd Sputnik7 naar Venus gehouden?
Waarom werd Sputnik7 naar Venus gehouden?  Waarom is Mars Sky Red?
Waarom is Mars Sky Red?  Het goede nieuws over plastic afval
Het goede nieuws over plastic afval Ingenieurs die NASA's Voyager 1-telemetriegegevens onderzoeken
Ingenieurs die NASA's Voyager 1-telemetriegegevens onderzoeken Ambient Mode aangekondigd voor sommige Android-telefoons
Ambient Mode aangekondigd voor sommige Android-telefoons Waterzuiverende beker maakt drinkbaar water uit kreken en beken
Waterzuiverende beker maakt drinkbaar water uit kreken en beken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

