
Wetenschap
Hoe zijn zuren en basen verschillend Hoe verschillen hun pH -valieën?
zuren en basen:een verhaal van twee uitersten
Zuren en basen zijn twee fundamentele soorten chemische stoffen met contrasterende eigenschappen. Hier zijn hoe ze verschillen:
1. Chemische definitie:
* zuren: Stoffen die waterstofionen (H+) in een oplossing doneren.
* Bases: Stoffen die waterstofionen (H+) accepteren in een oplossing, of hydroxide-ionen (OH-) in een oplossing doneren.
2. Smaak:
* zuren: Meestal zuur. Denk aan citroensap of azijn.
* Bases: Meestal bitter en voelen zich glad aan als aanraking. Denk aan zeep of bakpoeder.
3. PH -schaal:
* zuren: Een pH -waarde minder dan 7 hebben. Hoe lager de pH, hoe sterker het zuur.
* bases (of alkalalis): Een pH -waarde groter dan 7 hebben. Hoe hoger de pH, hoe sterker de basis.
* Neutrale stoffen: Heb een pH van 7, zoals puur water.
4. Chemische reacties:
* zuren: Reageer met bases om zouten en water te vormen.
* Bases: Reageer met zuren om zouten en water te vormen.
5. Voorbeelden:
* zuren: Zoutzuur (HCL), zwavelzuur (H2SO4), citroenzuur (gevonden in citrusvruchten)
* Bases: Natriumhydroxide (NaOH), calciumhydroxide (Ca (OH) 2), ammoniak (NH3)
Samenvattend:
* Zuren zijn waterstofiondonoren en hebben een pH minder dan 7.
* Bases zijn waterstofionenacceptoren of hydroxide -ionendonoren en hebben een pH groter dan 7.
De pH -schaal is een logaritmische schaal, wat betekent dat elke eenheidsverandering in pH een tienvoudige verandering in zuurgraad of basiciteit vertegenwoordigt. Een oplossing met een pH van 3 is bijvoorbeeld tien keer zuurder dan een oplossing met een pH van 4.
Het begrijpen van de verschillen tussen zuren en basen is cruciaal op verschillende gebieden, waaronder chemie, biologie en dagelijks leven. Het kennen van de pH van een stof is bijvoorbeeld essentieel voor het beheersen van de eigenschappen en toepassingen.
 Waarom is het nodig om de zijkanten van beker te krabben voor kristallen vormt?
Waarom is het nodig om de zijkanten van beker te krabben voor kristallen vormt?  Welk element zal eerder reageren met zuurstof natrium of calcium, leg je uit of je je kunt bedanken?
Welk element zal eerder reageren met zuurstof natrium of calcium, leg je uit of je je kunt bedanken?  Hoe microben de opname van kwik kunnen helpen verminderen
Hoe microben de opname van kwik kunnen helpen verminderen  Onderzoeksteam maakt hydroxylamine uit lucht en water
Onderzoeksteam maakt hydroxylamine uit lucht en water  Welk type binding is waterstof?
Welk type binding is waterstof?
Hoofdlijnen
- Onderzoek werpt licht op hoe zeedieren stress overleven
- Welk organisme wordt beïnvloed door zwerfafval?
- Wie is er begonnen met de wetenschap?
- Hoe verschillen koolhydraten -eiwitten en lipiden in structuurfunctie?
- Factoren die betrokken zijn bij celdifferentiatie
- Hoe neuronale herkenning van zangvogelgeluiden zich in de loop van de tijd ontvouwt
- Waarom werden primaire droge cellen ontwikkeld?
- Is genie genetisch?
- DNA en RNA leveren bewijs van evolutie omdat?
- Het bestuderen van virale uitbraken in afzonderlijke cellen zou nieuwe manieren kunnen onthullen om ze te verslaan

- Natures antivries biedt formule voor duurzamer beton
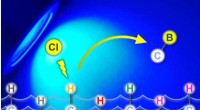
- Dankzij een nieuwe benadering in de organische chemie kan boor met hoge precisie aan moleculen worden toegevoegd
- Zonnebrandcrème en cosmetica kunnen koraal beschadigen door vetzuren te veranderen

- Naar een milieuvriendelijke productie van actieve farmaceutische ingrediënten met een flowreactor

 Niet meer anoniem:combineer genetica met genealogie om de doden in ongemarkeerde graven te identificeren
Niet meer anoniem:combineer genetica met genealogie om de doden in ongemarkeerde graven te identificeren Het noordpoolgebied brandt op een geheel nieuwe manier
Het noordpoolgebied brandt op een geheel nieuwe manier Op ionenoptica gebaseerde kwantummicroscoop kan individuele atomen in beeld brengen
Op ionenoptica gebaseerde kwantummicroscoop kan individuele atomen in beeld brengen Door welk proces worden rotsen sediment?
Door welk proces worden rotsen sediment?  Waar bevindt de kern zich in plantencel?
Waar bevindt de kern zich in plantencel?  Nieuwe metingen tonen aan dat de maan gevaarlijke stralingsniveaus heeft
Nieuwe metingen tonen aan dat de maan gevaarlijke stralingsniveaus heeft  Wat de innerlijke of terrestrische planeten niet bevatten?
Wat de innerlijke of terrestrische planeten niet bevatten?  Onderzoekers simuleren kwantumcomputer met maximaal 61 kwantumbits met behulp van een supercomputer met datacompressie
Onderzoekers simuleren kwantumcomputer met maximaal 61 kwantumbits met behulp van een supercomputer met datacompressie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

