
Wetenschap
Bereken de kookpunthoogte van een zoutwateroplossing die 3,40 g NaCl opgelost in 148 ml water bevat?
1. Bereken de molaliteit van de oplossing:
* Molaire massa NaCl: 58.44 g/mol
* mol NaCl: (3,40 g NaCl) / (58,44 g / mol) =0,0582 mol NaCl
* Mass van water (in kg): 148 ml * (1 g/ml) * (1 kg/1000 g) =0,148 kg
* molaliteit (m): (0,0582 mol NaCl) / (0,148 kg water) =0,393 mol / kg
2. Bereken de hoogte van het kookpunt:
* Boiling Point Elevation Constant (KB) voor water: 0,512 ° C/m
* Van't Hoff -factor (i) voor NaCl: 2 (NaCl dissocieert in 2 ionen in oplossing:Na+ en Cl-)
* Kookpunthoogte (Δtb): i * kb * m =2 * 0,512 ° C/m * 0,393 mol/kg =0,404 ° C
3. Bepaal het nieuwe kookpunt:
* Normaal kookpunt van water: 100 ° C
* Nieuw kookpunt: 100 ° C + 0,404 ° C = 100.404 ° C
Daarom is de kookpunthoogte van de zoutwateroplossing 0,404 ° C en is het nieuwe kookpunt 100.404 ° C.
 Wat is vijver? Studie levert eerste datagestuurde definitie op
Wat is vijver? Studie levert eerste datagestuurde definitie op  Wat veroorzaakt de algencrisis in Florida?
Wat veroorzaakt de algencrisis in Florida?  Wat zijn enkele abiotische dingen in het regenwoud?
Wat zijn enkele abiotische dingen in het regenwoud?  De VS is de grootste uitstoter van koolstof in de geschiedenis. Waar staan andere naties?
De VS is de grootste uitstoter van koolstof in de geschiedenis. Waar staan andere naties? Inheemse boskap maakt bosbranden erger - en anders zeggen negeert de feiten
Inheemse boskap maakt bosbranden erger - en anders zeggen negeert de feiten
Hoofdlijnen
- Wetenschappers die anatomie bestuderen?
- Wat hebben osmose en diffusie gemeen?
- Wat zijn de verschillende vormen van een gen die bepalen kenmerk bekend als?
- Noem de belangrijkste spieren van het onderlichaam?
- Welke moleculen kunnen zonder hulp door het plasmamembraan gaan?
- Waarom verhuizen chloroplasten in Elodea?
- Wat is erpsin -enzym?
- Wat is een andere naam voor een gewone microscoop?
- Is een wortel abiotisch of biotisch?
- Nieuwe enzymsleutel voor een betere behandeling van de ziekte van Parkinson
- Hoogwaardige zelf-geassembleerde katalysator voor SOFC
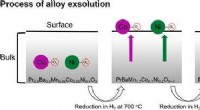
- Kenniskloof gedicht in ons begrip van degradatie van ethaan
- Team onthult katalysator die problematische CF-bindingen kan verbreken
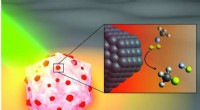
- Wetenschappers onthullen aard van geometrische fase-effecten in ultrakoude chemische reacties
 Welke heeft een grotere specifieke warmtecapaciteit een geleider of een isolator?
Welke heeft een grotere specifieke warmtecapaciteit een geleider of een isolator?  Hoe kunnen we de National Climate Assessment gebruiken om ons voor te bereiden op klimaatverandering?
Hoe kunnen we de National Climate Assessment gebruiken om ons voor te bereiden op klimaatverandering? Studie zegt dat zeeën sneller stijgen dan gedacht
Studie zegt dat zeeën sneller stijgen dan gedacht Onderzoek stelt nieuwe beperkingen aan donkere fotonen met behulp van een nieuwe diëlektrische optische haloscoop
Onderzoek stelt nieuwe beperkingen aan donkere fotonen met behulp van een nieuwe diëlektrische optische haloscoop Sjabloon om superatomen te maken kan zorgen voor betere batterijen
Sjabloon om superatomen te maken kan zorgen voor betere batterijen Zwemmer wordt geconfronteerd met haaien, enorme vuilnisbelt op record oversteek over de Stille Oceaan
Zwemmer wordt geconfronteerd met haaien, enorme vuilnisbelt op record oversteek over de Stille Oceaan Brexit fall-out:een onzekere toekomst voor academische wetenschappers
Brexit fall-out:een onzekere toekomst voor academische wetenschappers Hoeveel meter is het van de oostkust van ons naar de westkust?
Hoeveel meter is het van de oostkust van ons naar de westkust?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

