
Wetenschap
Zal natrium elektronen opgeven aan andere atomen?
* Elektronenconfiguratie: Natrium heeft één elektron in zijn buitenste schaal (valentieschaal). Dit enkele elektron is losjes gebonden en relatief eenvoudig te verwijderen.
* elektropositiviteit: Natrium is zeer elektropositief, wat betekent dat het een sterke neiging heeft om elektronen te verliezen en positief opgeladen te worden.
* octetregel: Door één elektron te verliezen, bereikt natrium een stabiele octetconfiguratie in de buitenste schaal, die een energieker gunstige toestand is.
Hoe natrium ionen vormt:
Wanneer natrium reageert met andere atomen, verliest het zijn buitenste elektron om een positief geladen ion te vormen, na⁺. Dit proces wordt ionisatie genoemd .
Voorbeelden:
* reactie met chloor: Natrium reageert met chloor om natriumchloride (NaCl) te vormen. Natrium verliest zijn elektron aan chloor en vormt Na⁺ en Cl⁻ -ionen, die elkaar vervolgens aantrekken vanwege hun tegengestelde ladingen.
* reactie met water: Natrium reageert krachtig met water, brengt waterstofgas vrij en vormt natriumhydroxide (NaOH). Het natriumatoom verliest zijn elektron om na⁺ -ionen te vormen.
Samenvattend, de neiging van natrium om zijn buitenste elektron te verliezen, maakt het een zeer reactief element dat gemakkelijk ionische bindingen vormt met andere elementen.
 Wat wordt gevormd door waterdamp in de lucht?
Wat wordt gevormd door waterdamp in de lucht?  Onderzoeksteam gebruikt berekeningen en experimenten om te begrijpen hoe nieuwe materiaaleigenschappen ontstaan
Onderzoeksteam gebruikt berekeningen en experimenten om te begrijpen hoe nieuwe materiaaleigenschappen ontstaan Nieuwe behandelingstechnologie kan de belasting van nucleair afval in het VK verminderen
Nieuwe behandelingstechnologie kan de belasting van nucleair afval in het VK verminderen Waarom zijn drankbladen gemaakt van staal?
Waarom zijn drankbladen gemaakt van staal?  Wat is de ionenlading op sulfaat?
Wat is de ionenlading op sulfaat?
 Wijdverbreide degradatie van permafrost gezien in hoog Arctisch terrein
Wijdverbreide degradatie van permafrost gezien in hoog Arctisch terrein Nieuwe rapporten zullen het VK in staat stellen zijn natuurlijke rijkdommen optimaal te benutten
Nieuwe rapporten zullen het VK in staat stellen zijn natuurlijke rijkdommen optimaal te benutten Heatstruck Italië begint zijn dorstige wijnstokken te oogsten
Heatstruck Italië begint zijn dorstige wijnstokken te oogsten SWOT-satelliet helpt de diepte van het tijdelijke meer van Death Valley te meten
SWOT-satelliet helpt de diepte van het tijdelijke meer van Death Valley te meten  Vulkaan Bali spuwt as 2,5 mijl de lucht in, luchthaven gesloten (update)
Vulkaan Bali spuwt as 2,5 mijl de lucht in, luchthaven gesloten (update)
Hoofdlijnen
- Babywitte haaien zijn het liefst dichter bij de kust, ontdekken wetenschappers
- Welk weefsel covrs en lijnen vele delen van het lichaam?
- Op welk substraat werkt speeksel amylase?
- In welke structuur ontwikkelt de eierstok zich?
- Welke drie dingen leveren bewijs dat organismen in de loop van de tijd zijn veranderd?
- Welke stoffen zitten in een plant in de suiker?
- Noem de buitenlandse en lokale wetenschapper hun werken?
- Onderzoek naar hoe genen activeren levert verrassende ontdekkingen op
- Wat veroorzaakt massa-uitstervingen? Uit onderzoek blijkt hoe invasieve soorten nieuw leven tegenhouden
- Een nieuw materiaal voor de batterij van de toekomst

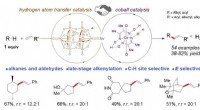
- Nieuwe methode voor functionalisering van koolstof-waterstofbindingen in een laat stadium
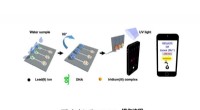
- Nieuw apparaat voor snelle en nauwkeurige detectie van lood
- Onderzoekers ontwikkelen nieuwe route naar chemisch recyclebare kunststoffen

- Onderzoekers vinden H-C-bindingen wanneer waterstofatomen met hoge snelheid botsen met grafeen
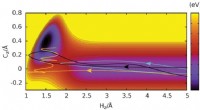
 'S Werelds grootste röntgenlaser opent enorme onderzoeksvergezichten
'S Werelds grootste röntgenlaser opent enorme onderzoeksvergezichten Wat wordt selenium gecombineerd met calcium?
Wat wordt selenium gecombineerd met calcium?  EPA heeft het screeningsniveau voor lood in de bodem verlaagd:dit is wat dit zou kunnen betekenen voor huishoudens in de VS
EPA heeft het screeningsniveau voor lood in de bodem verlaagd:dit is wat dit zou kunnen betekenen voor huishoudens in de VS  Afdekken, krimpen, cultiveren? Biologische bodembedekkingsmethoden onderzocht op onkruidbestrijding
Afdekken, krimpen, cultiveren? Biologische bodembedekkingsmethoden onderzocht op onkruidbestrijding  Wetenschappers ontwikkelen hoogwaardige lithium-zwavelbatterijen
Wetenschappers ontwikkelen hoogwaardige lithium-zwavelbatterijen Nieuwe ontdekking ondersteunt herbruikbare helmvulling
Nieuwe ontdekking ondersteunt herbruikbare helmvulling Waarom zie je de fasen van de maan overdag en nacht anders?
Waarom zie je de fasen van de maan overdag en nacht anders?  Nieuwe diamant harder dan een juweliersdiamant, snijdt door ultravaste materialen
Nieuwe diamant harder dan een juweliersdiamant, snijdt door ultravaste materialen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

