
Wetenschap
Hoe is H2O2 en 2OH anders?
waterstofperoxide (H₂o₂)
* Structuur: Twee zuurstofatomen die aan elkaar zijn gebonden, waarbij elk zuurstofatoom ook werd gebonden aan een waterstofatoom.
* eigenschappen:
* Kleurloze vloeistof bij kamertemperatuur.
* Sterk oxidatiemiddel.
* Ontleedt gemakkelijk in water (H₂o) en zuurstofgas (O₂).
* Gebruikt als een desinfectiemiddel, bleekmiddel en in raketbrandstof.
* chemische aard: Covalente verbinding, wat betekent dat de atomen elektronen delen.
Twee hydroxide -ionen (2oH⁻)
* Structuur: Elk hydroxide -ion bestaat uit één zuurstofatoom dat is gebonden aan één waterstofatoom. Het zuurstofatoom draagt een negatieve lading (anion).
* eigenschappen:
* Gevonden in basisoplossingen (alkalische) oplossingen.
* Kan reageren met zuren om water te vormen.
* Speelt een rol in veel chemische reacties en biologische processen.
* chemische aard: Ionen, wat betekent dat ze een netto elektrische lading hebben.
Belangrijkste verschillen:
* opladen: Waterstofperoxide is een neutraal molecuul, terwijl twee hydroxide -ionen een netto negatieve lading hebben.
* Structuur: Waterstofperoxide heeft een covalente binding tussen twee zuurstofatomen, terwijl hydroxide -ionen een covalente binding hebben tussen één zuurstof en één waterstof.
* Reactiviteit: Waterstofperoxide is een sterk oxidatiemiddel, terwijl hydroxide-ionen vaker betrokken zijn bij zuurbasisreacties.
Samenvattend: Waterstofperoxide en twee hydroxide -ionen zijn verschillende chemische soorten met verschillende structuren, ladingen en chemische eigenschappen.
 Waarom heeft ijs een lagere warmtecapaciteit dan vloeibaar water?
Waarom heeft ijs een lagere warmtecapaciteit dan vloeibaar water?  Uit welke twee delen bestaat de kern van een atoom?
Uit welke twee delen bestaat de kern van een atoom?  Reageert sterk zuur met base?
Reageert sterk zuur met base?  Wat zijn 4 gemeenschappelijke ferromagnetische materialen die in de natuur worden gevonden?
Wat zijn 4 gemeenschappelijke ferromagnetische materialen die in de natuur worden gevonden?  Wat zijn de twee primaire factoren die plaatsvinden in een moleculer -botsing?
Wat zijn de twee primaire factoren die plaatsvinden in een moleculer -botsing?
 Welk habitattype leven garnalen?
Welk habitattype leven garnalen?  Olifantentandpasta maken
Olifantentandpasta maken Australië brandt nog lang niet, maar regen brengt verlichting
Australië brandt nog lang niet, maar regen brengt verlichting Klimaatverandering legt een groeiende kloof bloot tussen het weer dat we hebben gepland en wat er gaat komen
Klimaatverandering legt een groeiende kloof bloot tussen het weer dat we hebben gepland en wat er gaat komen  Inheemse boskap maakt bosbranden erger - en anders zeggen negeert de feiten
Inheemse boskap maakt bosbranden erger - en anders zeggen negeert de feiten
Hoofdlijnen
- Wat levert glycolyse op?
- Waarom het laten ontsnappen van zalm gunstig zou kunnen zijn voor beren en vissers
- De vergelijkingen van het leven ontcijferen:een nieuwe theorie beschrijft wat alle dieren gemeen hebben
- Wat is de site van DNA -replicatie in eukaryoten?
- In welke levensfase komt mitose sneller voor?
- Gewelddadige dromen kunnen een aanwijzing zijn waarom dromen zijn geëvolueerd, zeggen onderzoekers
- Wat is etiolaat?
- Sportpartnerschappen met non-profitorganisaties laten matige resultaten zien, zo blijkt uit onderzoek
- Hoeveel markers worden gebruikt om een DNA -profiel te maken?
- De zuurtest doorstaan:nieuw systeem met lage pH recyclet meer koolstof in waardevolle producten

- Less is more:een zachte, zelfaangedreven pomp om mechatronische apparaten te vereenvoudigen
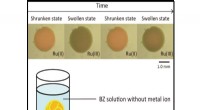
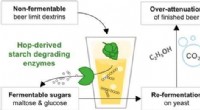
- Hoppig bier zonder ontploffende flessen en te veel alcohol
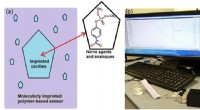
- Snelle detectie van toxische verbindingen
- Ongeneeslijke ziekten krijgen een nieuw hulpmiddel voor het ontdekken van RNA-geneesmiddelen

 Bibliografie voor de verdampingssnelheid van water aceton aniline chloroform?
Bibliografie voor de verdampingssnelheid van water aceton aniline chloroform?  Quantumsoftware uitvoeren op een klassieke computer
Quantumsoftware uitvoeren op een klassieke computer Vulkaan bij Tokio barst uit, waarschuwingen oproepen
Vulkaan bij Tokio barst uit, waarschuwingen oproepen Wat is het beste oppervlak om zonnewarmtewinst te minimaliseren?
Wat is het beste oppervlak om zonnewarmtewinst te minimaliseren?  Hoe bio-geïnspireerde katalysatoren te ontwikkelen
Hoe bio-geïnspireerde katalysatoren te ontwikkelen  De winnaar neemt alles:succes verbetert de smaak voor luxegoederen, studie suggereert:
De winnaar neemt alles:succes verbetert de smaak voor luxegoederen, studie suggereert: Is de zon een perfecte cirkel?
Is de zon een perfecte cirkel?  Nieuwe studie toont aan dat westerlingen op het platteland sterk voorstander zijn van milieubescherming
Nieuwe studie toont aan dat westerlingen op het platteland sterk voorstander zijn van milieubescherming
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

