
Wetenschap
Welke moleculen waren niet -polair omdat alle bindingen niet -polair?
Polariteit begrijpen
* Polaire bindingen: Tijdens twee atomen met verschillende elektronegativiteit (het vermogen om elektronen aan te trekken) delen elektronen ongelijk. Dit creëert een lichte positieve lading op het ene atoom en een lichte negatieve lading aan het andere.
* Niet -polaire bindingen: Tijdens twee atomen met vergelijkbare elektronegativiteit delen elektronen gelijk. Er is geen scheiding van lading.
* Niet -polaire moleculen: Een molecuul is niet -polair als al zijn bindingen niet -polair zijn en De vorm van het molecuul is symmetrisch. Dit betekent dat de polaire obligaties elkaar opzeggen.
Voorbeelden van moleculen met alle niet -polaire bindingen
* H₂ (waterstofgas): Beide waterstofatomen hebben dezelfde elektronegativiteit, dus de binding is niet -polair. Het molecuul is ook lineair en symmetrisch.
* CL₂ (chloorgas): Beide chlooratomen hebben dezelfde elektronegativiteit, wat resulteert in een niet -polaire binding. Het molecuul is lineair en symmetrisch.
* o₂ (zuurstofgas): Beide zuurstofatomen hebben dezelfde elektronegativiteit, waardoor een niet -polaire binding ontstaat. Het molecuul is lineair en symmetrisch.
* n₂ (stikstofgas): Beide stikstofatomen hebben dezelfde elektronegativiteit, wat resulteert in een niet -polaire binding. Het molecuul is lineair en symmetrisch.
* co₂ (koolstofdioxide): Hoewel koolstof en zuurstof verschillende elektronegativiteiten hebben, zijn de twee C =O -bindingen polair. De lineaire vorm van CO₂ betekent echter dat de polariteit elkaar annuleren, waardoor het molecuul niet -polair in het algemeen wordt.
Belangrijke opmerking: Alleen omdat een molecuul alle niet -polaire bindingen heeft, betekent dit niet automatisch dat het niet -polair is. De vorm van het molecuul speelt ook een cruciale rol. Water (H₂o) heeft bijvoorbeeld polaire bindingen, maar is een polair molecuul vanwege de gebogen vorm.
 Is natriummetaal explodeert in water een fysieke eigenschap?
Is natriummetaal explodeert in water een fysieke eigenschap?  Schrijf evenwichtige vergelijkingen voor de overdrachthydrogenering van zuiver glycerol -trioleaat met cyclohexeen en ammoniumformaat als waterstofbronnen?
Schrijf evenwichtige vergelijkingen voor de overdrachthydrogenering van zuiver glycerol -trioleaat met cyclohexeen en ammoniumformaat als waterstofbronnen?  Wat is het oxidatiegetal van fosfor in witte fosfor?
Wat is het oxidatiegetal van fosfor in witte fosfor?  Hebben O2 en O3 verschillende moleculaire structuren?
Hebben O2 en O3 verschillende moleculaire structuren?  Wat zou er gebeurd zijn als het mogelijk zou zijn om zuurstof uit de lucht te condenseren?
Wat zou er gebeurd zijn als het mogelijk zou zijn om zuurstof uit de lucht te condenseren?
 Experts bespreken voedselzekerheid uit oceanen
Experts bespreken voedselzekerheid uit oceanen De zeespiegel kan tegen 2100 met meer dan een meter stijgen als de emissiedoelstellingen niet worden gehaald
De zeespiegel kan tegen 2100 met meer dan een meter stijgen als de emissiedoelstellingen niet worden gehaald Senegalese wondergraan zou Sahel kunnen doen bloeien:TED
Senegalese wondergraan zou Sahel kunnen doen bloeien:TED Waarom de kleine boeren in Ghana niet enthousiast zijn over de laatste Groene Revolutie
Waarom de kleine boeren in Ghana niet enthousiast zijn over de laatste Groene Revolutie Vertrouwen op Tiger Woods:hoe beïnvloeden gezichtssignalen de voorkeur en het vertrouwen?
Vertrouwen op Tiger Woods:hoe beïnvloeden gezichtssignalen de voorkeur en het vertrouwen?
Hoofdlijnen
- Mannelijke reproductieve functies worden voornamelijk gecontroleerd door hormonen uit de hypothalamus en?
- Hoe zeeborstelwormen een speciaal eiwit gebruiken om onderscheid te maken tussen zonlicht en maanlicht
- Wat zijn schildklierblaasjes?
- Welk type organismen overleven het meest waarschijnlijk degenen met een smalle ecologische niche of brede niche?
- Hoe demonstreren vleugels van pinguïns en papegaaiduikers convergente evolutie?
- Waar komen voedingsstoffen het lichaam binnen?
- Welk product maakt voedselproductie efficiënter?
- Wat is turberculose?
- Kunnen dierencellen hun eigen cellen maken?
- Materialen op een nieuwe manier maken door 3D-printbacteriën
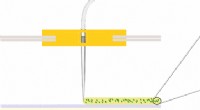
- Nieuwe strategie ter bevordering van hergebruik van met koolstofvezel versterkte kunststoffen
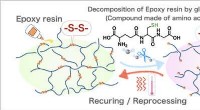
- Wetenschappers ontwikkelen veelbelovend nieuw type polymeer

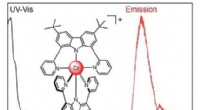
- Een nieuw chroomcomplex zendt licht uit in de ongrijpbare NIR-II-golflengte
- Afval omzetten in biobased chemicaliën

 Zou het voor u mogelijk zijn om de ster Betelgeuse te zien, zelfs als dat honderden jaren geleden was gestorven?
Zou het voor u mogelijk zijn om de ster Betelgeuse te zien, zelfs als dat honderden jaren geleden was gestorven?  Uitgebreide kijk op de fundamenten van de meest wenselijke nanobuisjes
Uitgebreide kijk op de fundamenten van de meest wenselijke nanobuisjes Hoe Eigenvectors te berekenen
Hoe Eigenvectors te berekenen Voor artiesten in lockdown, online wordt het nieuwe live
Voor artiesten in lockdown, online wordt het nieuwe live Collisies met elektronen koelen moleculaire ionen
Collisies met elektronen koelen moleculaire ionen Waarom vertoont acetylchloride een haloformreactie, ook al heeft het een keto-methylgroep?
Waarom vertoont acetylchloride een haloformreactie, ook al heeft het een keto-methylgroep?  Franse topfilosoof waarschuwt voor virusuitbuiting
Franse topfilosoof waarschuwt voor virusuitbuiting Wat is de verstoring die energie door een veld overbrengt?
Wat is de verstoring die energie door een veld overbrengt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

