
Wetenschap
Hoe gedraagt ammoniumchloride zich in water?
1. Hydrolyse:
* Wanneer ammoniumchloride oplost in water, dissocieert het in ammoniumionen (NH₄⁺) en chloride -ionen (CL⁻).
* De ammoniumion (NH₄⁺) ondergaat hydrolyse en reageert met watermoleculen om hydroniumionen (H₃o⁺) en ammoniak (NH₃) te vormen:
`` `
NH₄⁺ (aq) + h₂o (l) ⇌ h₃o⁺ (aq) + nH₃ (aq)
`` `
* De productie van hydroniumionen (H₃o⁺) maakt de oplossing zuur.
2. Chloride -ionen:
* Chloride -ionen (CL⁻) zijn de conjugaatbasis van een sterk zuur (HCl). Ze zijn zeer zwakke bases en dragen niet significant bij aan de pH van de oplossing.
3. Algemeen effect:
* Vanwege de hydrolyse van ammoniumionen wordt de oplossing zuur. De pH van een ammoniumchloride -oplossing zal minder zijn dan 7.
Andere eigenschappen:
* Ammoniumchloride is een witte kristallijne vaste stof die zeer oplosbaar is in water.
* Het wordt gebruikt in verschillende toepassingen, waaronder meststoffen, explosieven en als voedseladditief.
Samenvattend:
Ammoniumchloride gedraagt zich als een zuur zout in water omdat de ammoniumionen hydrolyse ondergaan, hydroniumionen produceren en de oplossing zuur maken.
 Hoe onvolledig is het fossielenbestand?
Hoe onvolledig is het fossielenbestand?  Kansas City non-profit maakt gebruik van een innovatief idee om de wereldwijde watercrisis op te lossen
Kansas City non-profit maakt gebruik van een innovatief idee om de wereldwijde watercrisis op te lossen Materiaalefficiëntie biedt een groot potentieel voor klimaatneutraliteit
Materiaalefficiëntie biedt een groot potentieel voor klimaatneutraliteit Moerasplanten en dieren
Moerasplanten en dieren  Natuurkundigen volgen atmosferische deeltjes die de rode lucht op maandag produceren
Natuurkundigen volgen atmosferische deeltjes die de rode lucht op maandag produceren
Hoofdlijnen
- Wat hebben isolatoren gemeen?
- Wat is geïnduceerd paaigans?
- DNA-barcodes:zijn ze altijd nauwkeurig?
- Radiologie werpt licht op oude vissoorten coelacanth
- Wat zijn de verschillen tussen biologisch en fylogenetisch concept van morfologische soorten?
- Onderwaterzweefvliegtuigen kunnen de manier veranderen waarop wetenschappers vissen volgen
- Waarom is replicatie belangrijk in de wetenschap?
- Overeenkomsten & verschillen tussen osmose en diffusie
- Jurassic ichthyosaurussen verdeelden voedselbronnen om naast elkaar te bestaan, vinden onderzoekers
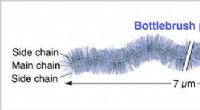
- 'S Werelds langste flessenborstelpolymeer ooit gesynthetiseerd
- De toekomst ziet er rooskleurig uit voor oneindig recyclebaar plastic

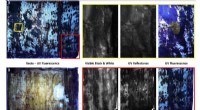
- Onderzoekers deconstrueren oud Joods perkament met behulp van meerdere beeldvormingstechnieken
- Tussenlagen helpen perovskietkristallisatie voor hoogwaardige light-emitting diodes

- Het mengen van zijde met polymeren kan leiden tot betere biomedische implantaten

 Wat is de vergelijking voor natriumhydroxide en aluminiumsulfaat?
Wat is de vergelijking voor natriumhydroxide en aluminiumsulfaat?  Planten die Amylase bevatten
Planten die Amylase bevatten  Cambrium Sixtymile Formation of Grand Canyon levert nieuwe bevindingen op
Cambrium Sixtymile Formation of Grand Canyon levert nieuwe bevindingen op Kun je de relativiteitstheorie in eenvoudige bewoordingen uitleggen?
Kun je de relativiteitstheorie in eenvoudige bewoordingen uitleggen?  Welke mate -lont moet u gebruiken om een circuit te beschermen dat 6 ampère draagt?
Welke mate -lont moet u gebruiken om een circuit te beschermen dat 6 ampère draagt?  Wat is een virale infectie waardoor de gastheercel barst en sterft om het nieuw gesynthetiseerd virus vrij te geven?
Wat is een virale infectie waardoor de gastheercel barst en sterft om het nieuw gesynthetiseerd virus vrij te geven?  Onderzoekers bestuderen hoe stedelijke bomen het milieu beïnvloeden
Onderzoekers bestuderen hoe stedelijke bomen het milieu beïnvloeden Wanneer natrium en chloorverbinding, veranderen hun eigenschappen?
Wanneer natrium en chloorverbinding, veranderen hun eigenschappen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

