
Wetenschap
De concentratie jodide -ionen in een 0,193 m oplossing Barium is?
De ontbrekende informatie:
* De bariumverbinding: In de vraag staat:"Een oplossing van 0,193 M." Dit is onvolledig. We moeten de specifieke bariumverbinding kennen Dat is opgelost in de oplossing. Voorbeelden kunnen zijn:
* Bariumjodide (bai₂)
* Bariumchloride (BACL₂)
* Bariumnitraat (ba (no₃) ₂)
hoe de jodideconcentratie te berekenen
1. Identificeer de bariumverbinding: U hebt deze informatie nodig uit de context van het probleem of van aanvullende details.
2. Schrijf de oplossingsvergelijking: Als de verbinding bijvoorbeeld bariumjodide (bai₂) is:
Bai₂ (s) → ba²⁺ (aq) + 2i⁻ (aq)
3. Bepaal de jodide -ionenverhouding: In dit voorbeeld produceert elke formule -eenheid van Bai₂ twee jodide -ionen (i⁻).
4. Bereken de jodideconcentratie:
* Als de bariumverbinding bai₂: is
* De jodideconcentratie is tweemaal De bariumconcentratie:0,193 m bai₂ * 2 = 0.386 m i⁻
belangrijke opmerkingen:
* Als de verbinding geen bariumjodide is, moet u de jodide -ionenverhouding aanpassen op basis van de chemische formule.
* Dit veronderstelt dat de bariumverbinding volledig oplost in water.
Laat het me weten als je de complete bariumverbinding kunt bieden en ik kan je de exacte jodide -concentratie geven!
 Chirurgische instrumenten maken van medisch afval
Chirurgische instrumenten maken van medisch afval Welke kleur zou universele indicator in bodem die alkalisch bevat?
Welke kleur zou universele indicator in bodem die alkalisch bevat?  Onderzoekers creëren een paradigmaverschuiving in de categorisatie van actieve locaties van katalysatoren, waardoor deuren worden geopend naar nieuw katalysatorontwerp
Onderzoekers creëren een paradigmaverschuiving in de categorisatie van actieve locaties van katalysatoren, waardoor deuren worden geopend naar nieuw katalysatorontwerp  Welke uitvinding maakt gebruik van vloeistoffen die erg koud zijn en warmte absorberen?
Welke uitvinding maakt gebruik van vloeistoffen die erg koud zijn en warmte absorberen?  Welke factor bepaalt de pH op het gelijkwaardigheidspunt?
Welke factor bepaalt de pH op het gelijkwaardigheidspunt?
 Wat zijn de 3 dingen die kunnen gebeuren met licht die een blad raken?
Wat zijn de 3 dingen die kunnen gebeuren met licht die een blad raken?  De ecologische voetafdruk van een volledig Engels ontbijt, en hoe het te verminderen?
De ecologische voetafdruk van een volledig Engels ontbijt, en hoe het te verminderen? Welke landvormen zijn gevormd aan een transformatiegrens?
Welke landvormen zijn gevormd aan een transformatiegrens?  Poeder kan helpen de CO2-uitstoot te verminderen
Poeder kan helpen de CO2-uitstoot te verminderen Onderzoek werpt nieuw licht op het begrijpen van Pacific Trade Winds
Onderzoek werpt nieuw licht op het begrijpen van Pacific Trade Winds
Hoofdlijnen
- Pancreas behoort tot welk orgelsysteem?
- Hoe de genenstroom tussen soorten de evolutie van Darwins vinken beïnvloedt
- Structuur van primaire optogenetische tool onthuld
- Hoe planten kunnen evolueren door het gebrek aan bijen
- Hoe de gecorrigeerde WBC-telling te berekenen
- Onderzoekers ontdekken dat een klein organisme de kracht heeft om een hardnekkig broeikasgas op landbouwvelden te verminderen
- Wat is Science Synoymns?
- Is een lommerrijke zeedragon eukaryotisch of prokaryotisch?
- Heeft u twee ethische kwesties over biotechnologie?
- ArtSea Ink:een kleurrijke, Op zeewier gebaseerde inkt voor 3D-printen

- Onderzoekers lokaliseren de grootste celreceptor van het lichaam
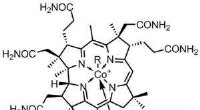
- Kankercellen targeten door elektrische stromen te meten

- De eerste mechanosynthese van een moleculair kristal met een Borromeaanse topologie

- Statistische gevolgtrekking om de werkwijze van een zeer ervaren kristallograaf na te bootsen
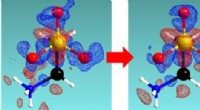
 Tot welke periode en groeps- en chemisch symbool behoren op het periodiek systeem?
Tot welke periode en groeps- en chemisch symbool behoren op het periodiek systeem?  Hoe maken consumenten online winkelkeuzes? De muis kan het antwoord bevatten
Hoe maken consumenten online winkelkeuzes? De muis kan het antwoord bevatten  Wat is de naam van de chemische samengestelde voor OSCL4?
Wat is de naam van de chemische samengestelde voor OSCL4?  Hoe zijn lypids en eiwitten vergelijkbaar?
Hoe zijn lypids en eiwitten vergelijkbaar?  Classificatie van petrochemicaliën
Classificatie van petrochemicaliën Door bosbranden is een kwart miljoen hectare verbrand
Door bosbranden is een kwart miljoen hectare verbrand Schadelijke effecten van cyclonen
Schadelijke effecten van cyclonen Wat vormt de bodem naast rotsdeeltjes minerale lucht en water?
Wat vormt de bodem naast rotsdeeltjes minerale lucht en water?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

