
Wetenschap
Welk oxide kan worden gereduceerd tot het metaal met koolstof?
Waarom koolstof werkt:
* Koolstof is een goed reductiemiddel: Koolstof heeft een sterke affiniteit voor zuurstof, wat betekent dat het gemakkelijk reageert met zuurstof om koolstofdioxide te vormen (CO₂). Deze reactie verwijdert zuurstof uit het metaaloxide.
* Hoge temperatuur: Het proces vereist meestal hoge temperaturen om de reactie naar voren te brengen.
Voorbeelden van metaaloxiden gereduceerd door koolstof:
* ijzeroxide (fe₂o₃): Dit is het meest voorkomende voorbeeld, dat wordt gebruikt bij de productie van ijzer in hoogovens.
* zinkoxide (ZnO): Gebruikt bij de productie van zinkmetaal.
* koperoxide (cuo): Gebruikt bij de productie van koperen metaal.
* loodoxide (PBO): Gebruikt bij de productie van loodmetaal.
Algemene reactie:
De algemene reactie voor carbothermische reductie kan worden weergegeven als:
`` `
Metaaloxide + koolstof → metaal + koolstofdioxide
`` `
specifiek voorbeeld (ijzeroxide):
`` `
Fe₂o₃ + 3c → 2fe + 3co
`` `
Factoren die de reductie beïnvloeden:
* stabiliteit van het metaaloxide: Meer stabiele metaaloxiden (bijv. Aluminiumoxide) vereisen hogere temperaturen en/of verschillende reductiemiddelen.
* Reactiviteit van koolstof: Verschillende vormen van koolstof (cola, houtskool) hebben verschillende reactiviteit.
* Temperatuur: Hogere temperaturen geven de voorkeur aan de reductiereactie.
Laat het me weten als je meer details wilt over specifiek metaaloxide of het proces van carbothermische reductie!
 New Englands 1816 Makreeljaar en klimaatverandering vandaag
New Englands 1816 Makreeljaar en klimaatverandering vandaag Het spijsverteringsstelsel van een Kangaroo
Het spijsverteringsstelsel van een Kangaroo Uit onderzoek blijkt dat de sneeuwredding in Californië in 2023 uit de megadroogte een bizarre gebeurtenis was. Wen er niet aan
Uit onderzoek blijkt dat de sneeuwredding in Californië in 2023 uit de megadroogte een bizarre gebeurtenis was. Wen er niet aan  Oude olievelden zijn mogelijk minder vatbaar voor geïnduceerde aardbevingen
Oude olievelden zijn mogelijk minder vatbaar voor geïnduceerde aardbevingen Waarborgen van de veiligheid van offshore koolstofopslag
Waarborgen van de veiligheid van offshore koolstofopslag
Hoofdlijnen
- Wat gebeurt er als we menselijke kwaliteiten toekennen aan bedrijven?
- Op het spoor van de mondiale klimaatverandering – vulkanisme als aanjager van het klimaat tijdens de Carnische Crisis
- De veiligere seks? Voor een weinig bekende primaat:een nieuw begrip van waarom vrouwtjes de mannetjes overleven
- Waar komt teennagelschimmels vandaan?
- Een fysieke kaart van een genoom geeft familieledenposities genen met afstanden gemeten?
- Moleculaire biologieactiviteit stopt bij welke Temptaurure?
- Dat geldt voor unipotente stamcellen A. Ze kunnen alleen produceren die zoals zij zijn. B. Ze gevonden bij dieren op lage trofische niveaus. C. hebben ze geen organellen ingesloten membr?
- Binaural beats:kalmeert deze auditieve illusie echt je hersenen?
- Hoe je hersenen werken
- Een nieuwe betaalbare en gebruiksvriendelijke technologie voor de diagnose van droge ogen

- Chemici ontwikkelen een methode om verbindingen voor geneesmiddelen te synthetiseren
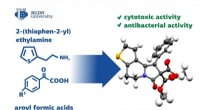
- Nieuw, volledig biologisch afbreekbaar cellulosemembraan blijkt effectief bij olie-waterscheiding

- Linkse of rechtse moleculen helpen materiële structuren

- Verbinding van geneeskrachtig kruid doodt hersenetende amoeben in laboratoriumstudies

 Slimme enkelprothese haalt angst uit ruw terrein, trap
Slimme enkelprothese haalt angst uit ruw terrein, trap Interview:Airbus is klaar voor onbemande vliegtuigen - jij ook?
Interview:Airbus is klaar voor onbemande vliegtuigen - jij ook?  Eeuwenoude scheepswrakken gevonden voor Singapore
Eeuwenoude scheepswrakken gevonden voor Singapore Hoe erg was de uitbarsting van Nevado del Ruiz?
Hoe erg was de uitbarsting van Nevado del Ruiz?  Wat is het tegenovergestelde van definitief?
Wat is het tegenovergestelde van definitief?  Wie heeft oorspronkelijk het concept voorgesteld dat materie bestaat uit kleine ondeelbare deeltjes?
Wie heeft oorspronkelijk het concept voorgesteld dat materie bestaat uit kleine ondeelbare deeltjes?  NASA-onderzoekers catalogiseren alle microben en schimmels op het internationale ruimtestation
NASA-onderzoekers catalogiseren alle microben en schimmels op het internationale ruimtestation Hoe Ouija-borden werken
Hoe Ouija-borden werken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

