
Wetenschap
Hoeveel gram HCl kan worden bereid uit 2,00 mol H2SO4 en 150 G NaCl?
1. Evenwichtige chemische vergelijking
De reactie tussen zwavelzuur (H₂so₄) en natriumchloride (NaCl) produceert zoutzuur (HCL) en natriumsulfaat (Na₂so₄):
H₂so₄ + 2Nacl → 2HCl + Na₂so₄
2. Bepaal de beperkende reactant
* h₂so₄: Je hebt 2,00 mol H₂so₄.
* NaCl: Converteer grams van NaCl in mol met behulp van zijn molaire massa (58,44 g/mol):
150 g NaCl * (1 mol NaCl / 58,44 g NaCl) =2,57 mol NaCl
Vergelijk om de beperkende reactant te vinden, vergelijk de molverhouding van reactanten met de gebalanceerde vergelijking:
* h₂so₄: 2,00 mol H₂so₄ / 1 =2,00
* NaCl: 2.57 Mol NaCl / 2 =1,29
De kleinere waarde (1.29) komt overeen met NaCl. Dit betekent dat NaCl de beperkende reactant is, omdat deze volledig zal worden geconsumeerd voordat alle H₂so₄ is opgebruikt.
3. Bereken de mol HCl geproduceerde
Met behulp van de stoichiometrie van de gebalanceerde vergelijking kunnen we de mol HC1 geproduceerd vinden:
2.57 mol NaCl * (2 mol HCl / 2 mol NaCl) =2,57 mol HCl
4. Converteer mol HCl naar grams
Gebruik de molaire massa van HCl (36,46 g/mol) om mol om te zetten in gram:
2.57 mol HCl * (36,46 g HCl / 1 mol HCl) = 93.7 g HCl
Daarom kan 93,7 gram HCl worden bereid uit de gegeven hoeveelheden reactanten.
 Bevatten zure en basische oplossingen ionen?
Bevatten zure en basische oplossingen ionen?  Wanneer een vloeistof sterk wordt verwarmd zijn dichtheid?
Wanneer een vloeistof sterk wordt verwarmd zijn dichtheid?  Wat is de gebalanceerde reactie wanneer een strook magnesium toegevoegd aan oplossingszilvernitraat?
Wat is de gebalanceerde reactie wanneer een strook magnesium toegevoegd aan oplossingszilvernitraat?  Wat is de lichtste stof onder deze vier 1oxygen 2Nitrogen 3Hydrogen 3carbon?
Wat is de lichtste stof onder deze vier 1oxygen 2Nitrogen 3Hydrogen 3carbon?  Waardevolle inzichten in de modellering, sollicitatie, en productie van bioactieve materialen
Waardevolle inzichten in de modellering, sollicitatie, en productie van bioactieve materialen
 Biologische producten promoten bij consumenten
Biologische producten promoten bij consumenten Klimaatverandering verdubbelde de kans op de Australische hittegolf
Klimaatverandering verdubbelde de kans op de Australische hittegolf Wil je klimaatverandering tegengaan? Hier zijn 8 stappen die je kunt nemen
Wil je klimaatverandering tegengaan? Hier zijn 8 stappen die je kunt nemen Wie was de eerste die de rol van de omgeving herkende als een belangrijke factor in evolutionaire verandering?
Wie was de eerste die de rol van de omgeving herkende als een belangrijke factor in evolutionaire verandering?  Is er sprake van een tornadospiraal in de natuur?
Is er sprake van een tornadospiraal in de natuur?
Hoofdlijnen
- Welke soorten organismen doen stikstoffixatie?
- Welke metabole route is gebruikelijk voor zowel cellulaire ademhaling als fermentatie?
- Deze dierenarts uit Texas heeft geholpen het mysterie van de vogelgriep bij koeien te ontrafelen
- Biologen werpen licht op hoe cellen hulpbronnen verplaatsen
- Wat regelt eigenschappen en erfenis?
- Anti-insuline-eiwit gekoppeld aan levensduur en voortplanting bij mieren
- Wat zijn de delen van de plant waar vrouwelijke en mannelijke gameten zich bevinden?
- Wat betekent filter in de wetenschap?
- Als twee chromosomen dezelfde genen hebben voor eigenschap, wordt gezegd dat ze zijn?
- Nieuwe ID-foto's van geleidende polymeren ontdekken een verrassende ABBA-fan

- Onderzoekers kijken naar schimmel om licht te werpen op kanker

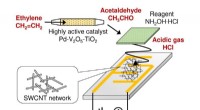
- Ontwikkeling van een kleine sensor die het fytohormoon ethyleen continu kan monitoren
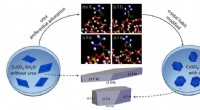
- Het effect van ureumadditieven op de fysisch-chemische eigenschappen van kristallen
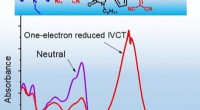
- Ingeschakelde IR-actieve organische pigmenten
 Welke metalen voeren warmte efficiënter uit?
Welke metalen voeren warmte efficiënter uit?  Wat zijn goede isolatoren en geleiders in een keuken?
Wat zijn goede isolatoren en geleiders in een keuken?  Wat is de overdracht van lichte energie naar deeltjes?
Wat is de overdracht van lichte energie naar deeltjes?  Kosten van de 20-jarige oorlog tegen het terrorisme:8 biljoen dollar en 900, 000 doden
Kosten van de 20-jarige oorlog tegen het terrorisme:8 biljoen dollar en 900, 000 doden Onderzoekers ontdekken waarom PSA-niveaus de progressie van prostaatkanker weerspiegelen
Onderzoekers ontdekken waarom PSA-niveaus de progressie van prostaatkanker weerspiegelen  Nieuwe studie om eerst te voorspellen welke olie- en gasbronnen methaan lekken
Nieuwe studie om eerst te voorspellen welke olie- en gasbronnen methaan lekken Hoe zijn graniet en dioriet vergelijkbaar met elkaar?
Hoe zijn graniet en dioriet vergelijkbaar met elkaar?  Waarom is koolstofdioxide beter oplosbaar bij hoge druk?
Waarom is koolstofdioxide beter oplosbaar bij hoge druk?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

